Эквивалентная масса вещества — это важное понятие в химии, которое определяет количество вещества, содержащего один эквивалент реакционной способности. Эквивалентная масса позволяет сравнивать вещества по их химической активности и проводить расчеты в химических реакциях.
Методы расчета эквивалентной массы вещества зависят от типа реакции и элементов, входящих в состав вещества. Для элементарных веществ эквивалентная масса равна их атомной массе. Для соединений эквивалентная масса может быть расчитана на основе их молярной массы и количества ионов, содержащихся в формуле соединения.
Давайте рассмотрим пример расчета эквивалентной массы на примере реакции между серной кислотой (H2SO4) и натрием (Na). Серная кислота содержит два иона водорода (H+) и один ион серы (SO42-). Натрий образует ион натрия (Na+). Эквивалентная масса серной кислоты будет равна молярной массе серной кислоты, деленной на количество ионов в реакции. В данном случае, эквивалентная масса серной кислоты будет равна молярной массе серной кислоты, деленной на два, так как два иона водорода участвуют в реакции.
- Что такое эквивалентная масса вещества
- Определение эквивалентной массы
- Значение эквивалентной массы в химии
- Связь эквивалентной массы с молярной массой
- Методы расчета эквивалентной массы
- Методы для элементов
- Методы для химических соединений
- Особенности расчета эквивалентной массы
- Примеры расчета эквивалентной массы
- 🔍 Видео
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Что такое эквивалентная масса вещества
Эквивалентная масса может быть вычислена для любого химического элемента или соединения и может быть выражена в разных единицах измерения, таких как г/моль, г/экв, кг/моль и т.д. В химических реакциях эквивалентная масса имеет огромное значение, так как она позволяет определить количество вещества, участвующего в реакции, и осуществить точные расчеты.
Определение эквивалентной массы основывается на формуле вещества и составляется на основе электрохимического эквивалента. Электрохимический эквивалент — это количество вещества, отделяющееся или превращающееся в продукте электролитической реакции при прохождении через электролит определенного количества электричества.
Для элементов эквивалентная масса соответствует их атомной массе или молярной массе, выраженной в г/экв. При расчете эквивалентной массы элементов можно использовать различные методы, такие как методы сравнения, методы измерения реакционной способности и другие.
Для химических соединений эквивалентная масса определяется на основе их формулы и молярной массы, а также учетом их стехиометрии. При расчете эквивалентной массы соединений также могут использоваться различные методы, включая методы измерения взаимодействия и прочие.
Особенности расчета эквивалентной массы связаны с учетом стехиометрических коэффициентов в химических реакциях, а также с учетом конкретных условий реакции. Расчет эквивалентной массы имеет широкое применение в химических анализах, каталитических реакциях, синтезе органических соединений и других областях химии.
Определение эквивалентной массы
Эквивалентная масса вещества определяется как масса данного вещества, которая реагирует с единичным количеством другого вещества, принятого за базовый экивалент. Базовый эквивалент выбирается исходя из реакционных пропорций и химической формулы вещества.
Определение эквивалентной массы позволяет установить соотношение между массой вещества и его реакционной активностью. Чем меньше эквивалентная масса вещества, тем большее количество данного вещества будет реагировать с другими веществами.
Эквивалентная масса обычно выражается в г/мол и может быть использована для расчета массовых и объемных соотношений в химических реакциях. Зная эквивалентную массу вещества, можно рассчитывать количество данного вещества, реагентов и продуктов реакции.
Важно отметить, что эквивалентная масса зависит от химической формулы вещества и его молярной массы. Определение эквивалентной массы основано на изучении стехиометрических соотношений в химических реакциях и может быть применено к различным типам веществ, включая элементы и химические соединения.
Определение эквивалентной массы вещества является основой для понимания и проведения химических расчетов. Эта концепция позволяет более точно прогнозировать результаты химических реакций и оптимизировать химические процессы в различных областях науки и промышленности.
Значение эквивалентной массы в химии
Эквивалентная масса выражается в г/экв и зависит от химического элемента или соединения. Она равна молярной массе вещества, деленной на количество эквивалентов.
Например: для элемента водорода (H) эквивалентная масса будет равна 1 г/экв, так как молярная масса водорода равна 1 г/моль, а у него один эквивалент.
Значение эквивалентной массы часто используется для определения количества вещества, необходимого для проведения химической реакции. Это позволяет знать, какое количество реагентов требуется или образуется в реакции.
Кроме того, значение эквивалентной массы может быть использовано для расчета процентного содержания вещества в смеси, поскольку оно показывает относительное количество эквивалентов вещества в сравнении с другими компонентами.
Связь эквивалентной массы с молярной массой
Связь между эквивалентной массой и молярной массой основана на стехиометрии реакции. Рассмотрим пример: для реакции, в которой один моль вещества реагирует с одним эквивалентом другого вещества, эквивалентная масса первого вещества будет равна его молярной массе.
Однако, в реакциях, где участвуют другие коэффициенты стехиометрии, эквивалентная масса не будет равна молярной массе. В этом случае, эквивалентная масса определяется как отношение молярной массы к числу эквивалентов, участвующих в реакции. В общем случае, эквивалентная масса выражается в г/экв.
Эквивалентная масса играет важную роль в химии, особенно в расчетах количества вещества и массы, участвующей в реакциях. Она позволяет определить массу вещества, необходимую для достижения определенной химической реакции. Это позволяет провести точные и эффективные эксперименты, а также управлять и контролировать процессы в химической промышленности.
Связь между эквивалентной массой и молярной массой помогает ученым и химикам понять, как различные вещества взаимодействуют друг с другом и как влияют на химические процессы. Понимание этой связи является ключевым для прогнозирования результатов реакции и разработки новых химических соединений и материалов.
Видео:Эквивалент. Часть 1. Эквивалент элемента. Задачи.Скачать

Методы расчета эквивалентной массы
При расчете эквивалентной массы для элементов используется их атомная масса. То есть эквивалентная масса элемента равна его атомной массе, выраженной в граммах.
Для расчета эквивалентной массы химических соединений необходимо знать их формулу и молярную массу. Если формула химического соединения известна, молярная масса может быть рассчитана путем суммирования масс атомов, составляющих соединение. После определения молярной массы требуется разделить ее на число эквивалентов вещества в соединении. Число эквивалентов равно количеству замещаемых или образующихся между веществами атомов или молекул в химической реакции.
Особенности расчета эквивалентной массы заключаются в том, что она может быть разной для разных видов химических реакций. Например, для обменных реакций эквивалентная масса вещества рассчитывается как отношение молярной массы к стехиометрическим коэффициентам реагирующих веществ. В случае окислительно-восстановительных реакций эквивалентная масса рассчитывается с учетом изменения валентности элемента в окислительной или восстановительной половинке реакции.
Примеры расчета эквивалентной массы могут включать рассмотрение реакции между кислородом и водородом, где количество водорода, необходимого для реакции с одним молем кислорода, равно 2. Таким образом, эквивалентная масса водорода будет равна молярной массе водорода, деленной на 2.
Методы для элементов
Для расчета эквивалентной массы элемента по атомному весу необходимо сначала определить количество граммов атомов этого элемента. Затем нужно установить, какой из атомов элемента является единицей эквивалентной массы. Для этого необходимо определить количество граммов этого атома, равное его атомной массе. Затем полученное количество граммов атомов элемента нужно сравнить с массой единицы эквивалентной массы этого элемента и отношение между ними даст эквивалентную массу элемента.
Еще одним методом для расчета эквивалентной массы элемента является определение количества групп кислорода или водорода, которое связывается с данным элементом в химической реакции. Затем количество граммов этого элемента необходимо сравнить с массой соответствующей группы кислорода или водорода, которая является единицей эквивалентной массы.
Важно отметить, что методы расчета эквивалентной массы элементов могут различаться в зависимости от химических свойств и особенностей каждого конкретного элемента. Поэтому перед расчетом необходимо изучить специальную литературу или обратиться к таблицам химических элементов для получения точных данных.
Методы для химических соединений
Расчет эквивалентной массы для химических соединений имеет свои особенности по сравнению с расчетом для элементов. В случае химического соединения нужно учитывать не только массу каждого элемента, но и их соотношение в соединении.
Существует несколько методов для расчета эквивалентной массы химических соединений:
1. Метод на основе стехиометрии
Этот метод основан на изучении стехиометрического соотношения между элементами в химическом соединении. Таким образом, для расчета эквивалентной массы необходимо знать массу каждого элемента в соединении и его молярную массу. Затем используется формула:
Эквивалентная масса = (масса элемента / молярная масса элемента) × стехиометрический коэффициент
Например, рассмотрим соединение H2O (вода). Известно, что молярная масса воды равна 18 г/моль. Пусть необходимо рассчитать эквивалентную массу для элемента кислорода (O). Из химического соотношения известно, что одна молекула воды содержит один атом кислорода. Следовательно, эквивалентная масса кислорода равна:
Эквивалентная масса O = (16 г / моль) × 1 = 16 г/экв
2. Метод на основе реакционной способности
Этот метод основан на изучении реакционной способности химического соединения. Идея заключается в том, что эквивалентная масса соединения определяется количеством вещества, которое оно может отдать или принять в реакциях. Для расчета эквивалентной массы необходимо знать количество вещества соединения, участвующего в реакции, и количество соединения, на которое оно реагирует или с которым оно образует соединение. Затем используется формула:
Эквивалентная масса = (масса соединения / количество вещества соединения) × количество соединения на одно вещество
Например, рассмотрим реакцию образования NaCl (хлорид натрия) из Na (натрия) и Cl2 (хлор). Известно, что масса Na равна 23 г, масса Cl2 равна 71 г, и масса NaCl равна 58,5 г. Пусть необходимо рассчитать эквивалентную массу для NaCl. Из химического уравнения реакции известно, что на одну молекулу NaCl приходится одна молекула Na и две молекулы Cl2. Следовательно, эквивалентная масса NaCl равна:
Эквивалентная масса NaCl = (58,5 г / 1 моль) × 1 моль = 58,5 г/экв
Использование одного из указанных методов позволяет правильно рассчитать эквивалентную массу химического соединения. Этот параметр играет важную роль в химических расчетах и позволяет определить количество вещества, которое может участвовать в реакциях.
Особенности расчета эквивалентной массы
1. Учет стехиометрических коэффициентов
При расчете эквивалентной массы необходимо учитывать стехиометрические коэффициенты в реакции. Они показывают, в каком соотношении вещества участвуют в химической реакции. Коэффициенты позволяют правильно определить массу вещества, соответствующую одному эквиваленту.
2. Учет валентностей
Валентность элемента определяет его способность к образованию химических связей и количество электронов, которое он может отдать или принять. При расчете эквивалентной массы необходимо учитывать валентности элементов в соединении. Они позволяют определить количество электронов, участвующих в реакции, и соответствующую массу вещества, соответствующую одному эквиваленту.
3. Учет веществ с переменной степенью окисления
Некоторые вещества могут иметь переменную степень окисления в различных соединениях. При расчете эквивалентной массы таких веществ необходимо учитывать их среднюю степень окисления в данной реакции. Это позволяет получить более точное значение эквивалентной массы и более правильно провести химический расчет.
4. Учет различных типов химических реакций
Расчет эквивалентной массы может отличаться в зависимости от типа химической реакции. Например, для реакции окислительно-восстановительной необходимо учитывать изменения степеней окисления элементов, а для реакции кислотно-основной — замещение ионов и реакцию ионов водорода. Правильный учет типа реакции позволяет провести точные расчеты и получить достоверные результаты.
Изучение особенностей расчета эквивалентной массы позволяет углубиться в теоретические основы химии и правильно проводить химические расчеты. Это важный этап в понимании химических реакций и применении их в практических задачах.
Видео:133. Эквивалент. Молярная масса эквивалента.Скачать

Примеры расчета эквивалентной массы
Для наглядности рассмотрим несколько примеров расчета эквивалентной массы вещества.
Пример 1:
Рассмотрим кислоту HCl. Чтобы найти эквивалентную массу этой кислоты, необходимо найти количество вещества, содержащего один эквивалент.
Молярная масса HCl равна 36.46 г/моль. Давайте установим, сколько граммов HCl содержит один эквивалент:
Эквивалентная масса HCl = молярная масса HCl / нормальность HCl
Нормальность HCl известна и равна 0.1 Н (нормальным раствором считается раствор, содержащий один эквивалент растворенного вещества в одном литре раствора).
Таким образом, эквивалентная масса HCl = 36.46 г/моль / 0.1 Н = 36.46 г/моль / 0.1 моль/л = 364.6 г/л
Таким образом, эквивалентная масса HCl равна 364.6 г/л.
Пример 2:
Рассмотрим аммиак NH3. Чтобы найти эквивалентную массу аммиака, необходимо найти количество вещества, содержащего один эквивалент.
Молярная масса NH3 равна 17.03 г/моль. Нормальность NH3 также известна и равна 1.0 Н.
Эквивалентная масса NH3 = молярная масса NH3 / нормальность NH3
Эквивалентная масса NH3 = 17.03 г/моль / 1.0 Н = 17.03 г/моль / 1.0 моль/л = 17.03 г/л
Таким образом, эквивалентная масса NH3 равна 17.03 г/л.
Пример 3:
Рассмотрим оксид кальция CaO. Найдем эквивалентную массу оксида кальция.
Молярная масса CaO равна 56.08 г/моль, а нормальность CaO составляет 0.5 Н.
Эквивалентная масса CaO = молярная масса CaO / нормальность CaO
Эквивалентная масса CaO = 56.08 г/моль / 0.5 Н = 56.08 г/моль / 0.5 моль/л = 112.16 г/л
Таким образом, эквивалентная масса CaO равна 112.16 г/л.
Все эти примеры показывают, как можно расчитать эквивалентную массу вещества. Зная эквивалентную массу, мы можем более точно проводить химические расчеты и использовать данную величину в различных химических уравнениях и формулах.
🔍 Видео
Как применять закон эквивалентов в решении задачСкачать

Эквиваленты Закон эквивалентовСкачать

Эквивалент и закон эквивалентовСкачать

Находим эквивалент вещества часть 1Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Расчет молярной массы эквивалентовСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химический эквивалент и фактор эквивалентности в реакциях ионного обменаСкачать

Способы выражения концентрации растворов. 8 класс.Скачать

132. Фактор эквивалентности. Число эквивалентности.Скачать

Что такое эквивалент?Скачать
Определение концентрации вещества в растворе методом титриметрииСкачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Решение задач на эквивалентыСкачать

Химический эквивалентСкачать
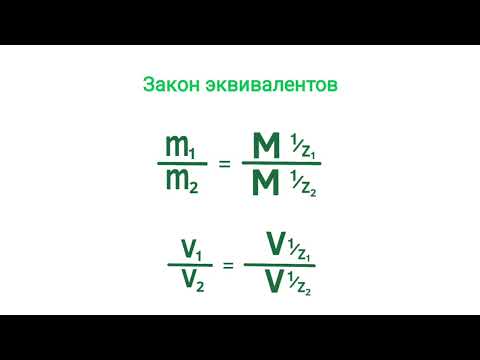
МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Шаихова Б.К. Определение эквивалентной массы магния методом вытеснениеСкачать

