Электронная конфигурация атома – это способ записи расположения электронов в его энергетических уровнях. Она помогает определить химические свойства и положение элемента в периодической таблице. Одной из форм записи электронной конфигурации является электронная формула, в которой электроны располагаются по подуровням в порядке возрастания энергии.
Рассмотрим электронную формулу 1s22s22p63s23p4. Здесь число 1 в 1s означает наличие 1 электрона на первом энергетическом уровне (s-подуровень). Число 2 в 2s указывает на наличие 2 электронов на втором энергетическом уровне (s-подуровень). Число 2 в 2p означает наличие 2 электронов на втором энергетическом уровне (p-подуровень).
Кроме того, число 3 в 3s указывает на наличие 3 электронов на третьем энергетическом уровне (s-подуровень), а число 4 в 3p означает наличие 4 электронов на третьем энергетическом уровне (p-подуровень). Исходя из электронной формулы, можно определить, что она соответствует элементу, находящемуся на третьем периоде и в шестой группе (кислородная группа) периодической таблицы.
Видео:8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Что такое электронная формула?
В электронной формуле используются буквы, цифры и индексы. Буквы обозначают электронные орбитали, а цифры и индексы показывают количество электронов в каждой орбитали.
Например, электронная формула 1s22s22p63s23p4 соответствует элементу, у которого в первой электронной оболочке содержится 2 электрона (1s2), во второй электронной оболочке — 2 электрона (2s2), в третьей электронной оболочке — 6 электронов (2p6), в четвертой электронной оболочке — 2 электрона (3s2) и в пятой электронной оболочке — 4 электрона (3p4).
С помощью электронной формулы можно определить принадлежность элемента к определенной группе и периоду в таблице Менделеева. Она также позволяет предсказывать некоторые свойства элемента, такие как его химическая активность и способность образовывать соединения.
Изучение электронных формул является важной частью химического анализа и помогает установить состав вещества и реакционные возможности элементов.
Определение электронной формулы
Электронная формула представляет собой запись, которая отображает расположение и количество электронов в атоме или ионе элемента. Она позволяет узнать информацию о энергетических уровнях и подуровнях электронов, а также о количестве электронов на каждом уровне.
Электронная формула включает символы, числа и буквы, которые имеют свои специальные значения и обозначают различные субуровни электронов. Если первым символом стоит число, оно указывает на основной энергетический уровень, на котором находятся электроны. Буквы s, p, d и f обозначают субуровни электронов. Числа перед буквами указывают на количество электронов на каждом субуровне.
Например, электронная формула 1s2 означает, что на первом энергетическом уровне находится 2 электрона, а на субуровне s находится 1 электрон. Электронная формула 2p3 означает, что на втором энергетическом уровне находится 5 электронов, а на субуровне p находится 3 электрона.
Электронные формулы играют важную роль в химии, так как позволяют представить структуру атомов и ионов элементов. Они помогают определить взаимодействия электронов и химических связей между элементами, а также понять химические свойства веществ. Поэтому знание электронной формулы элемента позволяет идентифицировать и определить его химическое поведение и свойства.
Структура электронной формулы
Электронная формула используется для описания распределения электронов в атоме. Она представляет собой последовательность чисел и букв, которая указывает количество электронов, находящихся в каждом энергетическом уровне и подуровнях атома.
Структура электронной формулы основана на принципах электронной конфигурации атома. В атоме есть несколько энергетических уровней, обозначаемых буквами K, L, M и т.д. Каждый энергетический уровень имеет подуровни, обозначаемые буквами s, p, d, f и т.д. Подуровни различаются формой орбиталей электронов — s-орбитали сферической формы, p-орбитали шарообразной формы и т.д.
Структура электронной формулы состоит из обозначения энергетического уровня, подуровня и числа электронов в данном подуровне. Например, формула 1s22s22p63s23p4 описывает распределение электронов в атоме в следующем порядке: 1s2, 2s2, 2p6, 3s2, 3p4.
Такая структура электронной формулы позволяет определить, сколько электронов находится на каждом энергетическом уровне и подуровне. Например, формула 1s22s22p63s23p4 указывает, что в атоме находится 2 электрона на энергетическом уровне 1s, 2 электрона на уровне 2s, 6 электронов на уровне 2p, 2 электрона на уровне 3s и 4 электрона на уровне 3p.
Структура электронной формулы имеет большое значение в химии, так как она определяет электронную конфигурацию атома. Электронная конфигурация, в свою очередь, определяет химические свойства элемента, его реактивность и способность образовывать химические связи.
Важно отметить, что каждому элементу соответствует уникальная электронная формула. Так, формула 1s22s22p63s23p4 соответствует элементу сера (S). Это означает, что у атома серы есть 16 электронов, распределенных по энергетическим уровням и подуровням в указанной формуле.
Таким образом, структура электронной формулы играет важную роль в определении электронной конфигурации атома и его химических свойств. Понимание и использование электронных формул позволяет углубить знания о строении атома и его химических свойствах.
Роль электронной формулы в химии
Электронная формула играет ключевую роль в химии, поскольку она позволяет определить структуру атома и его свойства. В химии атомы объединяются в молекулы, и их электронная формула определяет, как эти атомы связаны друг с другом.
Электронная формула состоит из электронных оболочек, которые содержат электроны. От расположения электронов на этих оболочках зависят химические свойства элемента и его способность реагировать с другими элементами.
Обычно электронные оболочки разделяются на энергетические уровни, называемые также квантовыми уровнями. Каждый уровень может содержать определенное число электронов. Электронная формула показывает, сколько электронов находится на каждом уровне и как они распределены по подуровням.
Зная электронную формулу элемента, химики могут предсказать его реакционную активность, способность образовывать химические связи или реагировать с другими веществами. Более того, электронная формула помогает идентифицировать элементы и изучать их свойства в лабораторных условиях.
Таким образом, электронная формула является основным инструментом для понимания и изучения химических свойств различных элементов. Благодаря ей, мы можем проникнуть в мир атомов и молекул и расширить наши знания о химии и ее применении в различных областях, таких как медицина, материаловедение и экология.
Видео:БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Какому элементу соответствует формула 1s22s22p63s23p4?
Формула 1s22s22p63s23p4 соответствует элементу серы (S). Электронная формула описывает расположение электронов в атоме, а также определяет его химические свойства.
В данной формуле число и буква обозначают энергетический уровень и тип орбитали, а верхние индексы отвечают за количество электронов в каждой орбитали. Таким образом, 1s22s22p63s23p4 означает, что элемент серы имеет два электрона на первом энергетическом уровне (орбиталь s), два электрона на втором энергетическом уровне (орбиталь s) и шесть электронов на третьем энергетическом уровне (четыре электрона в орбитали p и два электрона в орбитали s).
Сера (S) — это легкий неметаллический элемент, который находится в шестой группе периодической системы элементов. Он обладает химическим символом «S» и атомным номером 16. Сера имеет свойства, которые делают ее важной составной частью различных биомолекул и соединений, таких как аминокислоты, белки и некоторые лекарства.
Идентификация элементов по их электронной формуле является важным аспектом в химии. Зная электронную формулу, мы можем определить расположение и количество электронов в атоме, а также предсказать его химическое поведение и способность образовывать различные химические связи и соединения.
Таким образом, электронная формула 1s22s22p63s23p4 соответствует атому серы (S), который имеет общую структуру с двумя электронами на внутреннем энергетическом уровне и шестью электронами на внешнем энергетическом уровне.
Идентификация элемента по электронной формуле
Например, электронная формула 1s22s22p63s23p4 соответствует элементу сера (S). Рассмотрим ее структуру:
- 1s2 — означает, что в первом энергетическом уровне имеется 2 электрона;
- 2s2 — указывает на наличие 2 электронов во втором энергетическом уровне;
- 2p6 — говорит о наличии 6 электронов в подуровне 2p;
- 3s2 — указывает на наличие 2 электронов в третьем энергетическом уровне;
- 3p4 — говорит о наличии 4 электронов в подуровне 3p.
Таким образом, суммируя количество электронов, получаем общее число электронов в атоме серы, которое составляет 16. Исходя из данного числа, мы можем идентифицировать элемент как серу (S).
Идентификация элемента по электронной формуле является важным инструментом в химии, позволяющим определить химические свойства и поведение различных элементов в химических реакциях.
Определение элемента с электронной формулой 1s22s22p63s23p4
Электронная формула 1s22s22p63s23p4 соответствует элементу серы (S).
Электронная формула представляет собой запись, которая описывает расположение электронов в электронной оболочке атома. В этой формуле цифры и буквы указывают на количество электронов и энергетические уровни, на которых они находятся.
Структура электронной формулы разделена на блоки, где каждый блок обозначает наличие электронов на определенном энергетическом уровне. Буква s означает электроны на s-орбитах (сферическая симметрия), а буква p — электроны на p-орбитах (двухполюсная симметрия).
В электронной формуле 1s22s22p63s23p4 наблюдается следующее распределение электронов: на первом энергетическом уровне (s-орбита) находятся 2 электрона, на втором энергетическом уровне (s-орбита) — 2 электрона, на втором энергетическом уровне (p-орбита) — 6 электронов, на третьем энергитическом уровне (s-орбита) — 2 электрона и на третьем энергетическом уровне (p-орбита) — 4 электрона.
Электронная формула 1s22s22p63s23p4 соответствует элементу серы (S), который находится в 16 группе периодической системы. Сера (S) — это нетвёрдый химический элемент, который обладает химическим символом S и атомным номером 16. Он относится к группе благородных газов и является важным элементом в биологических системах и промышленности.
💥 Видео
Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

11 класс.Элементы 4 периода.Электронные формулы.Скачать

Движение электронов в атоме. 1 часть. 8 класс.Скачать

Электронные конфигурации атомов. Химия – простоСкачать

Как быстро составить электронную конфигурацию атома? [Лайфхак] Урок 5Скачать
![Как быстро составить электронную конфигурацию атома? [Лайфхак] Урок 5](https://i.ytimg.com/vi/_t7st9JNAGA/0.jpg)
Как решать 1 задание из ЕГЭ по химии "Электронная конфигурация атома"Скачать

ХИМИЯ ПРОСТО — Электронная конфигурация атомаСкачать

Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать

Электронные конфигурации первых 36 элементов для задания 1 | Химия ЕГЭ УМСКУЛ Богдан ЧагинСкачать

Электронные формулы атомов (практика). Учимся составлять электронные формулы атомов.Скачать

Электронные формулы d-элементов. Явление проскока электрона.Скачать

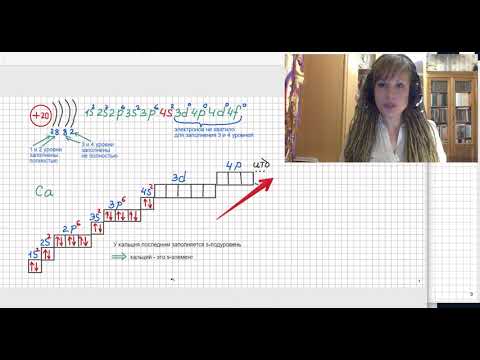
электронные формулы атомов кальция и ванадияСкачать
Химия| Элементарные частицы. Протоны. Нейтроны. Электроны.Скачать

Электронная конфигурация атома "Проскок электрона"Скачать

8 Класс. Распределение электронов в атоме | Электронные формулы - ПОЙМЁТ КАЖДЫЙСкачать

Строение атома и электронные орбиталиСкачать

как составить схему строения ионаСкачать
ХИМИЯ 8 класс: Электронная формула - как составлять? ВидеоурокСкачать

