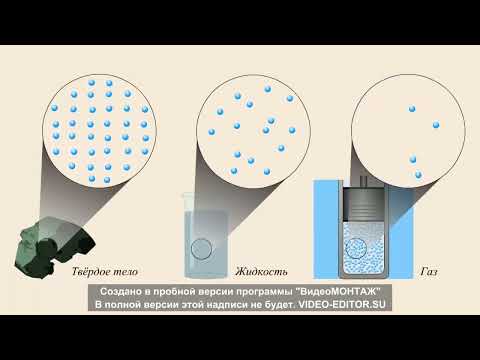
Молекулы — это маленькие частицы, из которых состоят все вещества. Они существуют в пространстве и постоянно двигаются, сталкиваясь друг с другом. Однако, несмотря на это, между молекулами обычно сохраняются определенные промежутки. Этому явлению лежат в основе физические основы, которые определяют поведение вещества и его свойства.
Расстояния между молекулами определяются силами притяжения и отталкивания между ними. Силы притяжения превалируют в твердых и жидких веществах, создавая упорядоченную структуру и сохраняя определенные промежутки между молекулами. В газовых веществах силы отталкивания преобладают, и молекулы находятся на больших расстояниях друг от друга.
Промежутки между молекулами вещества имеют важное значение для его свойств и поведения. Они, например, определяют объем вещества, его плотность и комбинаторные свойства. Промежутки также влияют на теплопроводность и электропроводность вещества. Благодаря сохранению этих промежутков, молекулы могут свободно двигаться и взаимодействовать друг с другом, обеспечивая устойчивость и структурированность вещества.
- Межмолекулярное взаимодействие и его роль в образовании промежутков
- Притяжение и отталкивание молекул
- Роль электронов в межмолекулярном взаимодействии
- Температурная зависимость промежутков между молекулами
- Влияние теплового движения на растяжение промежутков между молекул
- Изменение свойств вещества при низких и высоких температурах
- Физические свойства и химический состав вещества
- Размеры молекул и их влияние на промежутки
- Взаимодействие различных веществ в составе смеси
- 💡 Видео
Видео:Взаимное притяжение и отталкивание молекул | Физика 7 класс #6 | ИнфоурокСкачать

Межмолекулярное взаимодействие и его роль в образовании промежутков
Промежутки между молекулами возникают из-за различных сил взаимодействия между ними. Существуют разные типы межмолекулярных сил, такие как диполь-дипольное взаимодействие, силы ван-дер-Ваальса и водородные связи. Эти силы определяют способность молекулы притягивать или отталкивать другие молекулы.
Диполь-дипольное взаимодействие происходит между молекулами, которые имеют постоянный дипольный момент. В этом случае положительные и отрицательные части молекул притягиваются друг к другу, создавая промежутки между ними.
Силы ван-дер-Ваальса — это слабые силы притяжения, действующие между неполярными молекулами. Эти силы возникают из-за моментального образования небольшого диполя в молекуле, который приводит к притяжению к себе соседних молекул.
Водородные связи — это особый тип межмолекулярного взаимодействия, возникающий между водородной связью одной молекулы и электронной оболочкой другой молекулы. Водородные связи встречаются в веществах с атомами кислорода, азота или фтора, которые образуют острые углы с водородом.
Разные типы межмолекулярных взаимодействий и их силы влияют на изменение свойств вещества при разных условиях, включая температуру. При повышении температуры молекулы начинают двигаться быстрее, что приводит к расширению промежутков между ними.
Этот процесс объясняет, почему вещества могут изменять свои физические свойства при нагревании или охлаждении. Например, при низких температурах вещество может стать твердым, поскольку силы взаимодействия между молекулами становятся настолько сильными, что они удерживаются в фиксированном положении. При высоких температурах молекулы двигаются с большей скоростью и промежутки между ними увеличиваются, что делает вещество жидким или газообразным.
Размеры молекул также играют важную роль в создании промежутков между ними. Молекулы большего размера имеют более значительные промежутки, чем молекулы меньшего размера. Это может влиять на свойства вещества, такие как плотность и вязкость.
Межмолекулярное взаимодействие также определяет взаимодействие различных веществ в составе смеси. Если молекулы разных веществ обладают подходящими типами межмолекулярных взаимодействий, они могут взаимно притягиваться и образовывать смесь.
| Тип взаимодействия | Описание |
|---|---|
| Диполь-дипольное взаимодействие | Притяжение молекул с постоянным дипольным моментом |
| Силы ван-дер-Ваальса | Слабые силы притяжения между неполярными молекулами |
| Водородные связи | Притяжение молекул с атомами кислорода, азота или фтора |
Притяжение и отталкивание молекул
Притяжение между молекулами может быть обусловлено различными факторами, такими как взаимодействие между полярными молекулами, дипольно-дипольное взаимодействие, индукционное взаимодействие и дисперсное взаимодействие.
Полярные молекулы обладают неравномерным распределением электрического заряда. При взаимодействии с другими полярными молекулами происходит притяжение положительного и отрицательного зарядов, что приводит к образованию промежутков между молекулами.
Дипольно-дипольное взаимодействие возникает между молекулами с постоянным дипольным моментом. В этом случае положительный полюс одной молекулы притягивает отрицательный полюс другой молекулы, что также приводит к образованию промежутков.
Индукционное взаимодействие происходит, когда на одной молекуле возникает временный дипольный момент под влиянием внешнего поля других молекул. Это временное дипольное момент вызывает притяжение или отталкивание соседних молекул, образуя промежутки между ними.
Дисперсное взаимодействие является слабым притяжением, связанным с изменением электронного облака молекулы. Это взаимодействие происходит благодаря временной неравномерности электронного облака и создает промежутки между молекулами.
Помимо притяжения, межмолекулярные силы также могут вызывать отталкивание молекул. Отталкивание происходит в случаях, когда молекулы имеют одинаковый или близкий электрический заряд, а также в случаях столкновения молекул с высокой энергией.
Таким образом, притяжение и отталкивание молекул являются двумя противоборствующими процессами, которые определяют образование промежутков между молекулами вещества. Их интенсивность зависит от различных факторов, таких как химический состав вещества, размеры молекул и температура.
Роль электронов в межмолекулярном взаимодействии
Электроны — основные носители электрического заряда в атомах и молекулах. Они обладают отрицательным зарядом и вращаются вокруг ядер атомов. Именно электроны определяют свойства химических элементов и их способность образовывать химические соединения.
В межмолекулярном взаимодействии электроны играют роль притягивающего и отталкивающего фактора между молекулами. Их заряды взаимодействуют, создавая силы притяжения или отталкивания, которые влияют на расположение молекул друг относительно друга.
Когда электроны одной молекулы взаимодействуют с электронами другой молекулы, возникают электростатические силы притяжения. Этот тип взаимодействия называется ван-дер-ваальсовыми силами. Они могут быть слабыми или сильными в зависимости от силы зарядов электронов и расстояния между молекулами.
Кроме притяжения, электронная структура молекул также может вызывать отталкивание. Если электроны двух молекул находятся в одной области пространства, создается отрицательное электростатическое поле, которое отталкивает эти молекулы. Такие отталкивающие силы играют важную роль в поддержании определенного расстояния между молекулами и предотвращении их слияния.
Изменение расстояния между молекулами, вызванное межмолекулярным взаимодействием электронов, может привести к различным физическим свойствам вещества. Это может быть изменение температурной зависимости промежутков, влияние теплового движения на растяжение промежутков и изменение свойств вещества при низких и высоких температурах.
Таким образом, электроны играют важную роль в межмолекулярном взаимодействии и формировании промежутков между молекулами вещества. Изучение и понимание этой роли помогает лучше понять физические свойства и химический состав различных веществ и их взаимодействия в составе смесей.
Видео:Промежутки между молекулами. Диффузия. ФизикаСкачать

Температурная зависимость промежутков между молекулами
Температура вещества влияет на интенсивность теплового движения его молекул. При повышении температуры тепловое движение становится более интенсивным, и молекулы начинают занимать большие объемы пространства, что приводит к увеличению промежутков между ними.
Наоборот, при понижении температуры молекулы замедляют свое движение и начинают теснее прилегать друг к другу, что ведет к уменьшению промежутков между ними.
Температурная зависимость промежутков между молекулами вполне естественна, так как она связана с изменениями кинетической энергии молекул. Важно отметить, что эта зависимость варьирует в зависимости от вещества.
При высоких температурах промежутки между молекулами становятся более значительными, что объясняет свойство различных веществ расширяться при нагревании. Например, при нагревании жидкости она может переходить в газообразное состояние, так как высокая температура приводит к увеличению промежутков между молекулами и их отдалению друг от друга.
При низких температурах молекулы теснее прилегают друг к другу, что приводит к увеличению промежутков и, как следствие, к уменьшению объема вещества. Это объясняет свойство некоторых веществ сжиматься при охлаждении и переходить в твердое состояние.
Таким образом, температурная зависимость промежутков между молекулами играет важную роль в определении физических свойств вещества и его фазовых переходов. Изучение этой зависимости позволяет понять, как изменения температуры влияют на структуру и свойства материи.
Влияние теплового движения на растяжение промежутков между молекул
Когда вещество нагревается, его молекулы приобретают большую энергию, и их движение становится более интенсивным. Это приводит к увеличению промежутков между молекулами. В результате теплового движения молекулы начинают отдаляться друг от друга, расширяясь в объеме.
Напротив, при охлаждении вещества тепловое движение молекул замедляется, и их энергия снижается. Молекулы начинают сближаться друг с другом, что приводит к уменьшению промежутков между ними и сжатию вещества.
Изменение промежутков между молекулами под воздействием теплового движения является фундаментальным физическим явлением, влияющим на свойства вещества. Это обуславливает такие явления, как тепловое расширение при нагревании и тепловое сжатие при охлаждении.
Для визуального представления изменения промежутков между молекулами вещества под воздействием теплового движения можно использовать таблицу, где в первом столбце указаны различные температуры, а во втором столбце — соответствующие им промежутки между молекулами.
| Температура (°C) | Промежуток между молекулами (нм) |
|---|---|
| -100 | 0,1 |
| 0 | 0,2 |
| 100 | 0,3 |
| 200 | 0,4 |
| 300 | 0,5 |
Как видно из таблицы, с увеличением температуры промежутки между молекулами также увеличиваются, что свидетельствует о растяжении вещества. Важно отметить, что конкретные значения промежутков зависят от химического состава вещества и его физических свойств.
Таким образом, тепловое движение играет важную роль в изменении промежутков между молекулами, определяя физические свойства вещества и его поведение при различных температурах.
Изменение свойств вещества при низких и высоких температурах
При повышении температуры молекулы вещества начинают двигаться быстрее и преодолевать силы притяжения. В результате межмолекулярные промежутки увеличиваются, и вещество расширяется. Этот процесс называется термическим расширением. При достижении определенной температуры, называемой точкой плавления, кристаллическая решетка разрушается, и вещество переходит в жидкое состояние.
Дальнейшее повышение температуры приводит к увеличению энергии частиц, и молекулы начинают двигаться еще быстрее. При достижении точки кипения межмолекулярные силы становятся настолько слабыми, что молекулы вырываются из жидкости и образуют пар. Парообразование происходит по всему объему жидкости и зависит от давления и температуры.
При достижении высоких температур вещество может переходить в газообразное состояние без прохождения через жидкую фазу. Этот процесс называется сублимацией. При этом межмолекулярные промежутки становятся еще больше, и вещество занимает большие объемы.
Изменение свойств вещества при низких и высоких температурах играет важную роль в промышленных и научных процессах. Понимание этих процессов позволяет контролировать физические свойства веществ и использовать их для различных целей, например, при производстве материалов или химических реакциях.
Видео:Опыты по физике. Наличие промежутков между молекулами (модельный опыт)Скачать

Физические свойства и химический состав вещества
Физические свойства вещества напрямую связаны с его химическим составом. Каждое химическое вещество обладает уникальным набором физических свойств, которые определяют его поведение и взаимодействие с другими веществами.
Одним из основных физических свойств вещества является его состояние – твердое, жидкое или газообразное. Состояние вещества зависит от значений температуры и давления. Так, при низких температурах и высоких давлениях вещество может находиться в твердом состоянии, при повышении температуры и снижении давления оно может перейти в жидкое или газообразное состояние.
Другим важным физическим свойством вещества является плотность. Плотность определяет массу вещества, заключенную в единице объема. Различные вещества могут иметь различные плотности, что делает их различимыми и позволяет проводить различные физические и химические эксперименты.
Также физические свойства вещества включают в себя точку плавления и кипения, теплопроводность, электропроводность и многие другие. Эти свойства определяются наличием или отсутствием определенных веществ или их групп в составе вещества.
Однако, физические свойства вещества не всегда могут полностью описать его химический состав. Для полного определения химического состава вещества может потребоваться проведение химического анализа. Химический анализ позволяет определить, какие элементы и соединения находятся в составе вещества и в каких пропорциях. Это позволяет точнее понять и объяснить физические свойства данного вещества и его взаимодействие с другими веществами.
| Физические свойства | Химический состав |
|---|---|
| Температура плавления | Наличие и тип веществ, формирующих вещество |
| Теплопроводность | Наличие свободных электронов или других носителей энергии |
| Электропроводность | Наличие свободных заряженных частиц (ионов или электронов) |
| Плотность | Массовая доля вещества в единице объема |
Таким образом, физические свойства вещества и его химический состав тесно связаны друг с другом и взаимно определяют друг друга. Понимание этой связи позволяет более глубоко изучать и объяснять свойства и поведение вещества на молекулярном уровне.
Размеры молекул и их влияние на промежутки
Размеры молекул играют важную роль в формировании промежутков между ними. Когда молекулы вещества находятся близко друг к другу, электронные облака и ядра молекул начинают оказывать влияние друг на друга, притягиваясь или отталкиваясь.
Если молекулы сравнительно небольшие и имеют слабое электрическое поле, то межмолекулярные силы в основном являются слабыми. В таких случаях промежутки между молекулами могут быть достаточно маленькими, поскольку слабые взаимодействия не позволяют молекулам отталкиваться друг от друга сильно.
Однако, если молекулы крупные или имеют сильное электрическое поле, межмолекулярные силы становятся более сильными. В таких случаях промежутки между молекулами значительно увеличиваются, поскольку сильные взаимодействия между молекулами создают силу, которая отталкивает их друг от друга.
Таким образом, размеры молекул оказывают существенное влияние на промежутки между ними. Изменение размеров молекул может менять свойства вещества и его способность взаимодействовать с другими веществами. Понимание этого влияния позволяет улучшить наше понимание молекулярной структуры вещества и предсказывать его свойства и поведение.
Взаимодействие различных веществ в составе смеси
Притяжение между молекулами различных веществ может приводить к образованию промежутков между ними. Для некоторых смесей это притяжение может быть достаточно сильным, что приводит к образованию новых физических форм вещества, таких как растворы, суспензии или эмульсии.
Отталкивание между молекулами различных веществ может препятствовать образованию промежутков и смешиванию. В этом случае вещества могут быть несовместимыми и образовывать фазы или слои, не смешивающиеся друг с другом.
Особую роль взаимодействия различных веществ играют электроны. Электроны могут создавать электростатические силы притяжения или отталкивания между молекулами, в зависимости от их заряда и расположения. Это взаимодействие может быть важным фактором при формировании промежутков между молекулами различных веществ.
Также температура оказывает влияние на промежутки между молекулами. При повышении температуры молекулы начинают двигаться более активно и растягивать промежутки между собой. Это может привести к изменению свойств вещества, таких как его объем, вязкость или плотность.
Физические свойства и химический состав вещества также могут влиять на промежутки между молекулами. Например, размеры молекул могут определять доступность промежутков для других молекул. Большие молекулы могут занимать больше места и создавать меньше промежутков, чем маленькие молекулы.
Взаимодействие различных веществ в составе смеси может иметь большое значение как для практического применения смесей, так и для понимания основных физических и химических принципов. Знание о взаимодействии между молекулами разных веществ позволяет контролировать свойства и состояние смесей, что является важным в различных областях, включая химическую промышленность, медицину и пищевую промышленность.
💡 Видео
Различия в молекулярном строении газов, жидкостей и твердых тел | Физика 7 класс #8 | ИнфоурокСкачать

Урок 13 (осн). Взаимодействие молекул. Смачивание и несмачиваниеСкачать

Броуновское движение. Диффузия в жидкостях, газах и твердых телах | Физика 7 класс #5 | ИнфоурокСкачать

Строение вещества. Молекулы | Физика 7 класс #4 | ИнфоурокСкачать

Действие сил притяжения и отталкивания между молекулСкачать

Взаимное притяжение и отталкивание молекул. Агрегатные состояния вещества. Урок 4. Физика 7 классСкачать

Агрегатные состояния вещества | Физика 7 класс #7 | ИнфоурокСкачать

Физика 7 класс. 11 параграф. Взаимное отталкивание и притяжение молекулСкачать

Физика 7 класс (Урок№5 - Броуновское движение. Диффузия. Взаимное притяжение и отталкивание.)Скачать

Физика 7 класс (Урок№4 - Строение вещества. Молекулы и атомы. Измерение размеров малых тел.)Скачать

Строение вещества. Молекулы. Урок 4. Физика 7 классСкачать

Агрегатные состояния вещества. Расположение молекул воды в разных агрегатных состояниях.Скачать
Урок 139. Основные положения МКТ.Скачать

Основные положения молекулярно-кинетической теории | Физика 10 класс #24 | ИнфоурокСкачать

5. Строение вещества. Атомы и молекулы (часть 1)Скачать

Физика 7 класс. Строение вещества МолекулыСкачать

Урок 14 (осн). Три состояния веществаСкачать

