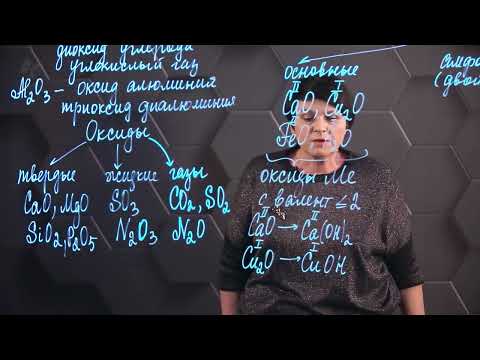Несолеобразующие оксиды – это класс химических соединений, которые обладают способностью реагировать с водой и образовывать кислоты. В отличие от солеобразующих оксидов, которые образуют соли в реакции с кислотами, несолеобразующие оксиды не образуют соли.
Один из наиболее известных несолеобразующих оксидов – углекислый газ (CO2). Он образуется при сгорании углеводородов и при дыхании живых организмов. Углекислый газ обладает высокой растворимостью в воде и является одним из основных компонентов атмосферы.
Несолеобразующие оксиды выполняют ряд важных функций в природе. Они участвуют в регулировании кислотно-щелочного баланса окружающей среды. Например, увеличение концентрации углекислого газа в атмосфере в результате человеческой деятельности приводит к увеличению кислотности океанов, что негативно сказывается на морской фауне и флоре.
Кроме того, несолеобразующие оксиды играют важную роль в металлургии и химической промышленности. Например, оксид азота (NOx) используется в процессе производства азотной кислоты, которая в свою очередь является одним из основных компонентов множества химических соединений, используемых в промышленности.
- Оксиды — важные соединения химических элементов
- Оксиды: определение и основные свойства
- Несолеобразующие оксиды: отличительные черты
- Функции несолеобразующих оксидов
- Использование несолеобразующих оксидов в промышленности
- Несолеобразующие оксиды как основа для создания материалов
- Несолеобразующие оксиды в природных процессах
- Практическое применение несолеобразующих оксидов
- Процессы окисления и восстановления с использованием несолеобразующих оксидов
- 🌟 Видео
Видео:ВСЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ ДЛЯ ЕГЭ ПО ХИМИИ 2024! | Химический сериал, 2 выпускСкачать

Оксиды — важные соединения химических элементов
Оксиды представляют собой важные соединения химических элементов, состоящие из кислорода и других химических элементов. Они обладают широким спектром свойств и применяются в различных сферах научных и промышленных отраслей.
Оксиды могут быть солеобразующими или несолеобразующими. В этой статье мы сосредоточимся на несолеобразующих оксидах, которые отличаются некоторыми особенностями по сравнению с другими типами оксидов.
Основные свойства несолеобразующих оксидов включают высокую реактивность, способность вступать в химические реакции с веществами, которые содержат электроотрицательные элементы, а также изменять pH среды.
Несолеобразующие оксиды широко используются в промышленности. Например, оксиды азота применяются в производстве удобрений, взрывчатых веществ и регуляторах роста растений. Оксиды серы используются в процессах очистки газов, производстве кислот и отбеливателях.
Кроме того, несолеобразующие оксиды являются основой для создания различных материалов. Например, оксид алюминия используется в производстве керамики, а оксид кремния — в производстве стекла и полупроводниковых материалов.
Несолеобразующие оксиды также играют важную роль в природных процессах. Например, оксиды углерода участвуют в процессах дыхания растений и животных, а также в формировании атмосферного воздуха. Оксиды железа являются составной частью руды и важны для производства стали и других металлов.
Практическое применение несолеобразующих оксидов разнообразно. Они используются для производства различных химических веществ, материалов и продуктов, а также в агропромышленном секторе в качестве удобрений и регуляторов роста растений.
Процессы окисления и восстановления также могут осуществляться с использованием несолеобразующих оксидов. Они могут быть важными инструментами для получения и преобразования различных химических соединений.
Оксиды: определение и основные свойства
Основные свойства оксидов:
- Оксиды образуются в результате соединения химического элемента с кислородом. В зависимости от элемента и степени окисления кислорода, могут образовываться различные соединения.
- Оксиды обычно обладают высокой температурой плавления и кипения. Некоторые оксиды, такие как оксиды железа, меди и алюминия, обладают также высокой твердостью.
- Многие оксиды обладают химической активностью, что делает их важными реагентами в различных химических процессах и промышленности.
- Оксиды могут быть кислыми, щелочными или амфотерными в зависимости от их химической природы и взаимодействия с водой.
- Некоторые оксиды обладают свойством изменять цвет в зависимости от условий окружающей среды. Например, оксид железа может быть как красным (Fe2O3), так и черным (Fe3O4).
- Оксиды могут быть использованы в различных областях, включая промышленность, строительство, электронику и медицину.
Оксиды являются важными соединениями химических элементов и выполняют различные функции в различных областях нашей жизни. Их свойства и вариации делают их уникальными и полезными для применения в различных сферах деятельности.
Несолеобразующие оксиды: отличительные черты
Одним из основных отличительных черт несолеобразующих оксидов является их некислотность. При контакте с кислотами они не образуют соли, как это делают другие классы оксидов, например, кислотообразующие оксиды.
Кроме того, несолеобразующие оксиды обычно обладают высокой химической стабильностью и стойкостью. Они не подвержены разложению или изменению состава при нормальных условиях окружающей среды.
Еще одной отличительной чертой несолеобразующих оксидов является их способность взаимодействовать с другими веществами и претворяться в различные соединения, не образуя солей.
Несолеобразующие оксиды выполняют некоторые важные функции во многих процессах. Например, они могут быть использованы в промышленности для производства различных материалов или в природных процессах для поддержания баланса химических реакций.
В общем, отличительные черты несолеобразующих оксидов определяют их значимость и широкое применение в различных областях науки и технологии. Изучение и понимание этих свойств безусловно является важным шагом в развитии химии и применении несолеобразующих оксидов для решения различных задач и проблем.
Видео:Характеристика и химические свойства оксидов | Химия ЕГЭ 10 класс | УмскулСкачать

Функции несолеобразующих оксидов
Несолеобразующие оксиды играют важную роль в химической промышленности и научных исследованиях. Они имеют различные функции и применения, благодаря которым они находят широкое применение в различных отраслях и областях жизни.
1. Катализаторы: Некоторые несолеобразующие оксиды могут использоваться в качестве катализаторов в химических реакциях. Они способны ускорять скорость реакций, не вступая в них самостоятельно. Катализаторы на основе несолеобразующих оксидов используются, например, в производстве синтетических материалов, водородных топливных элементах, производстве пластиков и катализе сжигания.
2. Окислители: Несолеобразующие оксиды могут использоваться в окислительных реакциях, где они служат источником кислорода. Оксиды таких элементов, как кислород, хлор, бром и многие другие, используются в качестве окислителей. Они могут применяться в различных отраслях, включая производство взрывчатых веществ, перекисное отбеливание, очистку воды и воздуха.
3. Сырье для производства материалов: Несолеобразующие оксиды часто используются в качестве сырья для производства различных материалов. Например, оксиды таких элементов, как алюминий, железо, кремний, медь и другие, являются основными компонентами для производства стали, алюминия, керамики, стекла и других материалов.
4. Консерванты и пигменты: Некоторые несолеобразующие оксиды, такие как оксиды цинка, меди, свинца и титана, могут использоваться в качестве консервантов для защиты от коррозии и гниения. Они также могут служить пигментами, добавляя цвет и яркость к различным материалам, включая краски, косметику и пластмассы.
5. Электролиты: Некоторые несолеобразующие оксиды, такие как оксиды лития и графита, могут использоваться в качестве электролитов в батареях и аккумуляторах. Они обеспечивают передачу ионов внутри батареи, что позволяет ей генерировать электрический заряд и работать эффективно.
Таким образом, несолеобразующие оксиды выполняют разнообразные функции и предлагают широкий спектр применений. Они являются неотъемлемой частью современной индустрии и науки, обеспечивая современный уровень развития и улучшая нашу жизнь.
Использование несолеобразующих оксидов в промышленности
Несолеобразующие оксиды, такие как оксид алюминия (Al2O3), оксид кремния (SiO2), оксид меди (CuO) и другие, имеют широкое применение в промышленности. Они используются в различных отраслях, включая металлургию, строительство, электронику, керамику и другие.
Одним из основных способов использования несолеобразующих оксидов является их применение в процессе производства стекла. Например, оксид кремния используется для придания стеклу прозрачности и прочности, а оксид алюминия добавляется для изменения его физических свойств и улучшения обрабатываемости.
Также несолеобразующие оксиды используются в качестве катализаторов в различных химических процессах. Например, оксид алюминия может быть использован в качестве катализатора при производстве пластмасс и резиновых изделий. Он способствует ускорению реакции и повышению качества продукции.
В промышленности несолеобразующие оксиды также используются для создания различных материалов. Например, оксид кремния используется для производства керамических изделий, таких как посуда, кафельная плитка и другие. Оксид меди может быть использован для создания электропроводных материалов, таких как провода и кабели.
Кроме того, несолеобразующие оксиды играют важную роль в природных процессах. Они могут быть найдены в почве, горных породах и водных растворах. Оксид железа, например, является одним из основных компонентов ржавчины и встречается в большом количестве горных пород.
Несолеобразующие оксиды как основа для создания материалов
Несолеобразующие оксиды играют важную роль в создании различных материалов. Они обладают уникальными свойствами, которые делают их особенно полезными в процессе разработки новых материалов и технологий.
Один из примеров использования несолеобразующих оксидов в создании материалов — это процесс синтеза керамики. Несолеобразующий оксид, такой как оксид алюминия, может использоваться в качестве основного компонента при создании керамических изделий. Он обладает высокой прочностью и стойкостью к различным воздействиям, что делает его отличным материалом для различных промышленных и научных целей.
Другим примером использования несолеобразующих оксидов в создании материалов является производство стекла. Одним из основных компонентов стекла является кремний, который является несолеобразующим оксидом. Кремний позволяет стеклу обладать прозрачностью, твердостью и стойкостью к воздействию различных химических веществ. Таким образом, несолеобразующие оксиды играют ключевую роль в создании различных видов стекла, таких как оконное стекло, посуда, оптические линзы и другие изделия.
Кроме этого, несолеобразующие оксиды также используются в процессе создания различных красителей и пигментов. Например, оксид железа используется для придания цвета различным материалам, включая краски, косметику и текстиль. Он обладает стабильностью и интенсивностью цвета, что делает его популярным выбором для производителей различных материалов.
Несолеобразующие оксиды также находят применение в процессе создания катализаторов. Катализаторы, такие как оксиды металлов, обладают способностью ускорять химические реакции, не участвуя в них самостоятельно. Это позволяет значительно повысить эффективность процессов производства и обработки различных материалов.
Таким образом, несолеобразующие оксиды играют важную роль в создании различных материалов. Их уникальные свойства делают их незаменимыми в производстве керамики, стекла, красителей и катализаторов. Благодаря этому, несолеобразующие оксиды продолжают находить все новые применения в различных отраслях промышленности и науки.
Несолеобразующие оксиды в природных процессах
Несолеобразующие оксиды играют важную роль во многих природных процессах. Они влияют на состав и свойства геологических и биологических систем, оказывая воздействие на окружающую среду и живые организмы.
Одним из наиболее известных примеров использования несолеобразующих оксидов в природных процессах является геологический цикл углерода. В этом процессе углерод окисляется до несолеобразующего оксида, диоксида углерода (CO2), который затем может переходить в раствор в воде и участвовать в различных химических реакциях. CO2 выполняет важную функцию в геохимических циклах и влияет на климатические изменения.
Другим примером применения несолеобразующих оксидов в природных процессах является окисление металлов. При контакте металлов с кислородом образуются оксиды, которые часто являются несолеобразующими. Эти оксиды могут дальше взаимодействовать с другими соединениями и влиять на химическую реакцию окисления металла.
| Несолеобразующий оксид | Функция в природных процессах |
|---|---|
| Диоксид серы (SO2) | Участие в геохимических циклах, влияние на климат |
| Диоксид азота (NO2) | Участие в формировании атмосферного аэрозоля и образовании кислотных дождей |
| Диоксид углерода (CO2) | Участие в геологическом цикле углерода и влияние на климат |
Несолеобразующие оксиды также могут участвовать в биологических процессах. Например, оксид азота (NO) является важным сигнальным молекулом в организмах животных и растений. Он участвует в регуляции кровяного давления, иммунной системы и других физиологических процессов.
Помимо этого, несолеобразующие оксиды используются в различных экологических процессах, например, в очистке воды и воздуха от вредных загрязнений. Оксиды могут быть использованы как катализаторы в различных химических реакциях, таких как окисление органических соединений или снижение концентрации определенных веществ в воздухе.
Таким образом, несолеобразующие оксиды играют важную роль в природных процессах, включая геохимические циклы, окисление металлов, биологические процессы и экологические процессы. Их использование и практическое применение имеют большое значение для нашей жизни и окружающей среды.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Практическое применение несолеобразующих оксидов
Несолеобразующие оксиды широко используются в различных отраслях нашей жизни благодаря своим специфическим свойствам. Они играют важную роль в процессах окисления и восстановления, а также в производстве разнообразных материалов. Рассмотрим основные области применения таких оксидов.
Одной из важных областей практического применения несолеобразующих оксидов является промышленность. Они используются в процессе производства стекла, керамики, эмали, цемента и других строительных материалов. Благодаря своим особым свойствам, несолеобразующие оксиды придают материалам прочность, твердость и другие необходимые характеристики.
Помимо строительной отрасли, несолеобразующие оксиды также находят применение в производстве катализаторов. Они играют роль активных компонентов, способствующих химическим реакциям, таким как окисление или восстановление в присутствии кислорода. Это позволяет ускорить процессы, повысить качество продукции и снизить стоимость производства.
Благодаря своей способности взаимодействовать с влагой и образовывать кислоты или щелочи, несолеобразующие оксиды также используются в химической промышленности. Они служат основой для получения различных соединений, таких как карбонаты, сульфаты и другие. Кроме того, несолеобразующие оксиды играют важную роль в очистке отходов и промышленных выбросов, обладая способностью нейтрализовывать кислотные или щелочные компоненты.
Не следует забывать и о природных процессах, где несолеобразующие оксиды также играют свою роль. Например, окисление в атмосфере способствует образованию озона, который защищает нашу планету от вредного ультрафиолетового излучения. Также несолеобразующие оксиды могут быть использованы при изучении минералов и геологических процессов.
Таким образом, практическое применение несолеобразующих оксидов охватывает множество сфер нашей жизни. Они являются важными компонентами в производстве материалов, катализаторов и химических соединений, а также играют роль в природных процессах. Их уникальные свойства открывают широкие возможности для применения в самых различных областях.
Процессы окисления и восстановления с использованием несолеобразующих оксидов
Одним из основных применений несолеобразующих оксидов является их использование в процессах окисления. Окисление — это процесс, при котором вещество теряет электроны. Несолеобразующие оксиды могут служить окислителями, участвуя в таких реакциях.
Например, многие несолеобразующие оксиды используются в процессах сжигания. Они применяются в качестве окислителей для поддержания горения и получения тепла или энергии. Также несолеобразующие оксиды широко применяются в производстве материалов и веществ. Они могут быть включены в состав катализаторов, реагентов и других химических соединений.
Восстановление — это процесс, обратный окислению, в котором вещество получает электроны. Несолеобразующие оксиды могут быть использованы в процессах восстановления для восстановления веществ до исходного состояния или в другое окислительное состояние.
Несолеобразующие оксиды также могут быть использованы в электрохимических процессах, таких как электролиз, где они выступают в роли электродов, взаимодействующих с раствором или электролитом.
Процессы окисления и восстановления с использованием несолеобразующих оксидов являются важными в различных сферах, таких как промышленность, производство энергии, химическая промышленность и многие другие. Они играют ключевую роль в создании новых материалов, химических соединений и продуктов.
Таким образом, несолеобразующие оксиды имеют широкий спектр применений в процессах окисления и восстановления, способствуя развитию современной науки и технологий и являясь важными составляющими во многих отраслях промышленности и научных исследований.
🌟 Видео
ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Типы оксидов за 2 минуты (8 классам)Скачать
СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ, которые увеличат твой балл на ЕГЭ по химииСкачать

Химия 8 класс (Урок№16 - Свойства, получение, применение оксидов.)Скачать

ОКСИДЫ основные кислотные амфотерные как отличить | Оксиды химия 8 классСкачать

СВОЙСТВА ОСНОВНЫХ ОКСИДОВ для ЕГЭ по химии | Химический сериал, 1 выпускСкачать

Химические свойства основных и кислотных оксидовСкачать

Образование основных и кислотных оксидов. 7 класс.Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химия 8 класс (Урок№15 - Оксиды: классификация, номенклатура.)Скачать

Несолеобразующие оксиды | ЕГЭ 2023Скачать

Несолеобразующие оксидыСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Оксиды. 1 часть. 8 класс.Скачать