Гибридизация является одним из фундаментальных понятий в химии. Она представляет собой процесс, при котором электроны в атоме перераспределяются и образуют новые орбитали с разными энергетическими уровнями. Этот процесс приводит к изменению формы и ориентации орбиталей атома, что влияет на его химические свойства и способность к образованию химических связей.
Гибридизация позволяет объяснить множество явлений и реакций в химии. Она помогает объяснить образование двойных и тройных связей, гибкость молекулярных структур, формирование молекул с простыми и сложными геометрическими формами, а также способность атомов образовывать координационные соединения и комплексы.
Основные типы гибридизации включают sp-, sp2- и sp3-гибридизацию. В гибридизации sp атомы образуют двойные связи и имеют линейную или плоскую форму, атомы в гибридизации sp2 образуют тройные связи и обладают трехугольной плоской формой, а атомы в гибридизации sp3 имеют четыре одинаковых связи и принимают форму тетраэдра.
Видео:Гибридизация атомных орбиталей и геометрия молекул. 10 класс.Скачать

Понятие гибридизации
Гибридные орбитали образуются путем комбинирования двух или более орбиталей разного типа (s, p, d) с целью получения орбиталей, которые обеспечивают более эффективное перекрытие с орбиталями других атомов в молекуле. Это позволяет образованию более прочных химических связей и устойчивых молекул.
Гибридизация в основном влияет на структуру атомов углерода, так как углерод является одним из наиболее гибридизуемых элементов. Для углерода существует три основных типа гибридизации: sp3, sp2 и sp. Каждый из этих типов гибридизации определяет их геометрию и химические свойства.
Гибридизация имеет важное значение в реакционных механизмах, так как определяет пространственное расположение атомов и их возможность взаимодействовать друг с другом. Это помогает понять, какие виды связей могут быть образованы и как протекают различные химические реакции.
Примеры гибридизации можно наблюдать во многих молекулах, включая органические соединения, такие как метан (CH4), этен (C2H4) и этин (C2H2). Каждая из этих молекул имеет разную геометрию и свойства, которые определяются их гибридизацией атомов углерода.
| Тип гибридизации | Описание | Примеры соединений |
|---|---|---|
| sp3 | Гибридизация, при которой четыре гибридных орбиталя образуются путем комбинирования одной s-орбитали и трех p-орбиталей. | Метан (CH4) |
| sp2 | Гибридизация, при которой три гибридных орбитали образуются путем комбинирования одной s-орбитали и двух p-орбиталей. | Этен (C2H4) |
| sp | Гибридизация, при которой две гибридных орбитали образуются путем комбинирования одной s-орбитали и одной p-орбитали. | Этин (C2H2) |
Определение гибридизации в химии
Основной механизм гибридизации заключается в комбинировании s- и p-орбиталей в новые h-орбитали. Гибридные орбитали имеют форму, более эффективно участвующую в образовании связей с другими атомами, что способствует стабилизации молекулярной структуры.
Гибридизация может происходить на трех основных уровнях — sp3, sp2 и sp, соответствующих гибридизации атомов углерода в органических соединениях. Sp3-гибридизация характеризуется образованием четырех гибридных орбиталей, что позволяет углеродному атому образовывать четыре однодонорных связи. Sp2-гибридизация имеет место, когда углеродный атом образует три гибридные орбитали, что позволяет образовывать три однодонорных связи. Sp-гибридизация связана с образованием двух гибридных орбиталей и двух однодонорных связей.
Гибридизация играет важную роль в химических реакциях, поскольку она определяет химическую активность и геометрию молекулы. Как правило, сп3-гибридизированные атомы углерода находятся в насыщенных (алканах) или частично насыщенных (алкенах и алкинах) соединениях. Атомы углерода, гибридизированные на уровне sp2, присутствуют в алкенах, являющихся несыщенными соединениями. Sp-гибридизированные атомы углерода обнаруживаются в алкине, представляющем собой тройную связь.
| Уровень гибридизации | Форма гибридных оебиталей | Примеры соединений |
|---|---|---|
| sp3 | четыре sigma-связи | метан, этилен, ацетилен |
| sp2 | три sigma-связи, одна pi-связь | этен, пропен, бутадиен |
| sp | две sigma-связи, две pi-связи | этин, пропин, бутин |
Таким образом, гибридизация в химии является важным феноменом, который определяет реакционную способность и структуру молекул. Понимание гибридизации помогает химикам предсказывать и объяснять свойства химических соединений и реакций, что имеет важное значение для различных областей науки и практики.
Значение гибридизации в химических реакциях
В химических реакциях гибридизация может индуцировать изменения в электронной структуре атомов, что в свою очередь приводит к формированию новых связей и образованию продуктов реакции.
Например, гибридизация атомов углерода влияет на тип образуемых связей и форму молекулы. Сп3-гибридизация атомов углерода приводит к образованию четырехспиральной формы, что позволяет образовывать одиночные связи со смежными атомами.
Сп2-гибридизация атомов углерода, с другой стороны, приводит к образованию трехспиральной формы, позволяющей образовывать двойные связи. Это имеет важное значение в реакциях, так как двойные связи могут быть подвержены электрофильной атаке или с посредничеством образования карбокатионов или карбонила.
Сп-гибридизация атомов углерода возникает при образовании графена или нанотрубок из углеродных волокон. Она обеспечивает прямые связи между атомами углерода, что приводит к образованию плоских или цилиндрических структур, обладающих уникальными электронными и механическими свойствами.
Таким образом, гибридизация атомов играет важную роль не только в определении формы молекулы, но и в определении ее свойств и способности к взаимодействию с другими молекулами в химических реакциях.
Видео:Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать

Примеры гибридизации
Один из примеров гибридизации – гибридизация атомов углерода. Атом углерода обычно имеет четыре электронные орбитали – s, px, py и pz. Однако, при гибридизации эти орбитали могут менять свою форму и энергию.
Основной пример гибридизации атомов углерода – сп3-гибридизация. В этом случае, углерод образует четыре сп3-гибридизованные орбитали, которые имеют форму сферы. Примеры веществ, содержащих сп3-гибридизированные атомы углерода, включают метан (CH4) и этилен (C2H6).
Еще один пример гибридизации атомов углерода – сп2-гибридизация. В этом случае, углерод образует три сп2-гибридизованные орбитали и одну электронную орбиталь s. Эти орбитали имеют форму плоского треугольника. Примером вещества, содержащего сп2-гибридизированный атом углерода, является этилен (C2H4).
Третий пример – сп-гибридизация атомов углерода. В этом случае, углерод образует две сп-гибридизованные орбитали и две электронные орбитали p. Сп-гибридизированные орбитали имеют форму линейной. Примеры веществ, содержащих сп-гибридизированные атомы углерода, включают ацетилен (C2H2) и формальдегид (CH2O).
Таким образом, гибридизация атомов углерода создает разнообразие орбиталей, что позволяет им образовывать связи с другими атомами и обеспечивать различные структуры органических соединений.
Сп3-гибридизация атомов углерода
Гибридизация осуществляется путем смешивания одной s-орбитали и трех p-орбиталей, которые находятся на разных энергетических уровнях, и образует четыре новых гибридных орбитали — sp3-гибридных орбитали. Эти орбитали имеют форму примерно сферического шара.
Сп3-гибридизация может быть проиллюстрирована на примере метана (CH4). В этой молекуле четыре атома водорода образуют связи с одним атомом углерода, а каждая связь обеспечивается одной sp3-гибридной орбиталью. Это позволяет метану иметь форму тетраэдра, где углы между связями составляют 109,5 градусов. Такая геометрия и определенная ориентация связей способствуют стабильности молекулы метана.
Сп3-гибридизация также происходит в молекулах этилена (C2H4), где два атома углерода образуют две двойные связи. При сп3-гибридизации одна sp3-гибридная орбиталь остается незанятой. Одна связь между атомами углерода образуется путем перекрытия двух sp3-гибридных орбиталей, а другая связь образуется путем перекрытия двух p-орбиталей.
| Молекула | Геометрия |
|---|---|
| Метан (CH4) | Тетраэдральная |
| Этилен (C2H4) | Плоская |
Сп3-гибридизация атомов углерода является важным концептом в органической химии, поскольку определяет пространственную структуру молекул и их свойства. Знание о сп3-гибридизации позволяет понять механизмы химических реакций и предсказывать свойства органических соединений.
Сп2-гибридизация атомов углерода
В результате сп2-гибридизации атома углерода образуется три новых гибридных орбиталя, которые имеют одинаковую энергию и направлены в плоскости треугольника с углом 120 градусов между собой. Таких орбиталей образуется ровно столько же, сколько связей будет участвовать в образовании.
Сп2-гибридизация атомов углерода позволяет образовывать двойные связи между углеродными атомами в органических молекулах. При этом одна из трех гибридных орбиталей занята связью с другим атомом, а две оставшиеся образуют π-связь между углеродными атомами.
Сп2-гибридизация позволяет атому углерода образовывать плоские молекулы, такие как алкены и ароматические соединения. В ароматических соединениях, например, бензоле, атомы углерода соединены двойными или тройными связями и образуют плоское шестиугольное кольцо.
| Примеры сп2-гибридизации атомов углерода |
|---|
| Этилен (C2H4) |
| Ацетилен (C2H2) |
| Бензол (C6H6) |
Сп2-гибридизация атомов углерода является важным понятием в химии органических соединений и играет значительную роль в определении их свойств и реакционной способности. Изучение гибридизации позволяет понять основы органической химии и является ключевым элементом в образовании химических специалистов.
Сп-гибридизация атомов углерода
Гибридизация атомов углерода представляет собой процесс, в результате которого образуется новый гибридный орбитальный набор, способный образовывать большое количество связей с другими атомами. Сп-гибридизация характерна для атомов углерода в алкинах.
Сп-гибридизация атомов углерода происходит следующим образом: одна из s-орбиталей атома углерода и две из p-орбиталей сливаются, образуя три новые орбитали, названные sp-гибридными орбиталями.
Каждая из трех сп-орбиталей атома углерода направлена в форме трех острых углов и ориентирована вдоль осей трех углеродных связей. Это означает, что каждая из трех sp-орбиталей может образовать связь с другим атомом в молекуле.
Примером сп-гибридизации атомов углерода является алкин, как, например, этилен (C2H2). В этом случае, два атома углерода образуют одну σ-связь между собой и две σ-связи с атомами водорода. Эти сп-орбитали обеспечивают структуру этилена с линейной геометрией и связями углерод-углерод.
Таким образом, сп-гибридизация атомов углерода играет важную роль в образовании и стабилизации молекул органических соединений, позволяя им иметь определенную геометрию и проводимость. Это понимание гибридизации атомов углерода позволяет ученым лучше понять и рационализировать свойства и реактивность органических соединений.
Видео:ЛЕКЦИЯ 1.1. ГИБРИДИЗАЦИЯ, СОПРЯЖЕНИЕ, АРОМАТИЧНОСТЬСкачать

Механизмы гибридизации
- Сп3-гибридизация атомов углерода — это механизм, в котором четыре орбитали s и p атома углерода переориентируются и сливаются в четыре новые орбитали sp3 с тетраэдрической геометрией. Этот механизм широко распространен в органической химии и обусловливает образование одиночных связей углеродных атомов.
- Сп2-гибридизация атомов углерода — в этом механизме три орбитали s и p атома углерода переориентируются и сливаются в три новые орбитали sp2 с плоской треугольной геометрией. Такая гибридизация возникает при образовании двойных связей углеродных атомов.
- Сп-гибридизация атомов углерода — в этом механизме две орбитали s и p атома углерода переориентируются и сливаются в две новые орбитали sp с линейной геометрией. Такая гибридизация характерна для образования тройных связей углеродных атомов.
Таким образом, механизмы гибридизации атомов углерода позволяют им формировать различные типы связей и обеспечивают разнообразие химических соединений. Данные механизмы являются основой для понимания и изучения реакций органической химии.
Процессы гибридизации в молекулах
Существует несколько типов гибридизации в молекулах, включая сп3-гибридизацию, сп2-гибридизацию и сп-гибридизацию. Каждый из них имеет свои особенности и применение в различных химических соединениях.
В процессе сп3-гибридизации атомы углерода переорганизуют свои электронные орбитали, чтобы образовать 4 сп3-гибридные орбитали. Это позволяет атому углерода образовывать 4 однотипных химических связи и иметь тетраэдрическую геометрию. Примером молекулы, где происходит сп3-гибридизация, является метан (CH4).
В случае сп2-гибридизации атому углерода требуется переорганизация электронных орбиталей, чтобы образовать 3 сп2-гибридные орбитали. Это позволяет атому углерода образовывать 3 однотипных химических связи и иметь плоскую треугольную геометрию. Примером молекулы, где происходит сп2-гибридизация, является этилен (C2H4).
Сп-гибридизация атому углерода требует реорганизации электронных орбиталей для образования 2 сп-гибридных орбиталей. Это позволяет атому углерода образовывать 2 однотипных химических связи и иметь линейную геометрию. Примером молекулы, где происходит сп-гибридизация, является ацетилен (C2H2).
Процессы гибридизации в молекулах являются ключевыми для образования различных химических соединений и определяют их свойства. Понимание этих процессов позволяет химикам предсказывать и объяснять структуру и реакционную способность соединений, что открывает путь к разработке новых лекарств, материалов и технологий.
📸 Видео
Метод молекулярных орбиталей. Часть 1. Основные понятия.Скачать
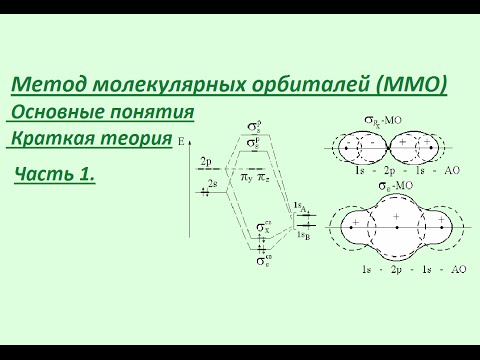
ХИМИЮ УЧИТЬ ЛЕГКО! ГибридизацияСкачать

Гибридизация - смысл. Разбор 10 молекул:CH4, NH3, H2O, C2H4, BCl3, SO2, SO3, BeCl2, CO2, C2H2.Скачать

Лайфхак по определению гибридизации за 7 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Все про гибридизацию на ЕГЭ по химии | УмскулСкачать

Теория гибридизации (Russian)Скачать
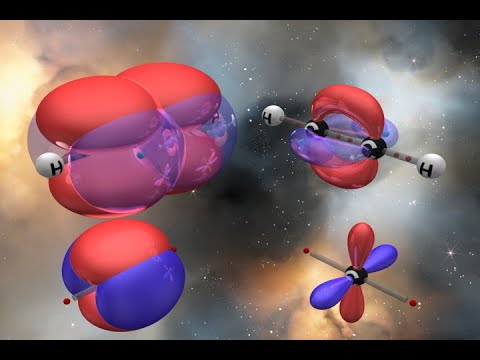
Органика. Виды гибридизации орбиталей (sp-, sp2-, sp3-гибридизация)Скачать

Химия | Гибридизация. Алгоритм определения гибридизацииСкачать

Гибридизация атома углерода | Химия ЕГЭ для 10 класса | УмскулСкачать

1. ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ (ЧАСТЬ 1)Скачать

Гибридизация для школьников, валентные состояния атома углерода (sp, sp², sp³)Скачать

СИГМА- ПИ- ДЕЛЬТА- СВЯЗЬСкачать

Гибридизация. Виды гибридизации. Теория для задания 12 ЕГЭ по химии.Скачать
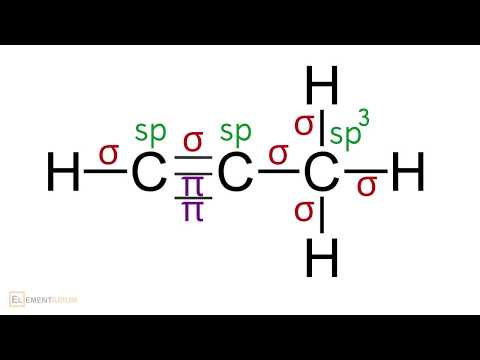
Определение типа гибридизации атомов в молекуле. Решение задач + ЕГЭСкачать

Все про гибридизацию в органической химии. [3] Органика С НУЛЯ | Химия для 10 класса и ЕГЭ-2024Скачать
![Все про гибридизацию в органической химии. [3] Органика С НУЛЯ | Химия для 10 класса и ЕГЭ-2024](https://i.ytimg.com/vi/jpjA3vkOzWg/0.jpg)
4. sp sp2 sp3 гибридизация, как определить?Скачать
Метод валентных связейСкачать

