Кислоты играют важную роль в химии и имеют свойства, которые определяют их силу. Одной из таких кислот является фосфорная кислота (H3PO4). Интересно узнать, является ли она сильной или слабой кислотой.
Фосфорная кислота обладает интересными химическими свойствами. Она состоит из трех молекул водорода (H) и одной молекулы фосфора (P). Конечно, именно соотношение этих элементов влияет на ее кислотность.
Согласно определению сильной и слабой кислоты, фосфорная кислота является слабой кислотой. Она обладает способностью выделяться в виде ионов в растворе, но не полностью и не сразу. Когда она взаимодействует с водой, происходит протолиз, и она выделяется в форме ионов Н+ (протон) и H2PO4- (дигидрофосфат). Это означает, что она может давать один протон в растворе и реагировать с базой.
Таким образом, мы можем заключить, что фосфорная кислота является слабой кислотой, поскольку она дает только один протон и лишь частично протонируется в водном растворе. Ее протолитическое равновесие достигается только в слабо кислых растворах.
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Что такое H3PO4?
H3PO4 обладает важными химическими свойствами и широко применяется в промышленности. Это бесцветная жидкость, которая легко растворяется в воде. H3PO4 является сильной кислотой и образует ионы водорода (H+) и фосфата (PO4-) в водном растворе. Также она может образовывать соли с различными металлами.
Фосфорная кислота широко используется в различных отраслях промышленности, включая производство удобрений, пластмасс, стекла, пищевых добавок и чистящих средств. Она также используется в химическом процессе электролитического металлизирования, при производстве электрических компонентов и в качестве катализатора в нефтепереработке.
H3PO4 имеет высокую степень диссоциации в водном растворе, что означает, что она полностью разделяется на ионы H+ и PO4- при контакте с водой. Это является одной из причин, по которой H3PO4 считается сильной кислотой.
Использование H3PO4 может оказывать негативное влияние на окружающую среду. Она может вызывать загрязнение водных ресурсов, так как неустойчивые ее соединения могут попадать в реки и озера. Поэтому важно правильно утилизировать и хранить эту кислоту, чтобы предотвратить негативное воздействие на окружающую среду.
Структура и свойства
H3PO4, или ортофосфорная кислота, представляет собой трехосновную кислоту, состоящую из трех молекул водорода (H) и одной молекулы фосфора (P). Ее формула химического соединения выглядит следующим образом: H3PO4.
Ортофосфорная кислота является бесцветной жидкостью, обладающей сильным запахом. Она хорошо растворима в воде и образует прозрачные растворы. Кроме того, H3PO4 может образовывать кристаллы, которые могут быть прозрачными или белыми.
Основные свойства H3PO4 связаны с ее кислотностью. Она относится к средне-сильным кислотам, обладающим избирательной противоплакатной активностью. Однако, она может образовывать со сталью пассивную пленку, что делает ее эффективным консервирующим средством для металлических поверхностей.
Ортофосфорная кислота может проявлять окислительное действие, особенно в присутствии некоторых соединений, таких как аммиак (NH3). Она часто используется в качестве катализатора в различных химических процессах и реакциях.
Токсичность H3PO4 в большой степени зависит от ее концентрации. В чистом виде она является едким и опасным веществом, способным вызвать химические ожоги на коже и слизистых оболочках. Поэтому ее использование требует соблюдения особых мер предосторожности.
Важно отметить, что данный уникальный текст был создан искусственным интеллектом на основе предоставленного плана статьи. Пожалуйста, проверьте текст на наличие ошибок и дополните его дополнительной информацией при необходимости.
Применение в промышленности
H3PO4 или ортофосфорная кислота имеет широкий спектр применения в промышленности. Её основные области применения включают:
- Химическая промышленность: H3PO4 является одной из основных кислот, используемых в процессах производства удобрений и минеральных удобрений;
- Производство пищевых добавок: H3PO4 используется в производстве пищевых добавок, таких как кислота E338, которая часто используется в производстве безалкогольных напитков и другой пищевой продукции;
- Металлургическая промышленность: H3PO4 применяется для обработки и очистки поверхностей металлических изделий, а также в процессах гальванического покрытия;
- Нефтеперерабатывающая промышленность: H3PO4 используется в процессе рафинирования нефти для удаления нежелательных примесей и улучшения качества продуктов;
- Производство кожи и текстиля: H3PO4 применяется для обработки кожи и текстиля, чтобы придать им нужные свойства, такие как стойкость к огню;
- Производство лекарственных препаратов: H3PO4 используется как компонент в процессе синтеза некоторых лекарственных препаратов;
- Производство бытовых и промышленных товаров: H3PO4 используется при производстве различных бытовых и промышленных товаров, таких как краски и лаки, мыло, губки и многое другое;
- Водоочистка и обработка сточных вод: H3PO4 применяется в процессах водоочистки для улучшения качества воды и удаления определенных загрязнений;
- Производство электроники: H3PO4 используется в процессе производства электронных компонентов, таких как микрочипы и полупроводники.
В целом, H3PO4 играет важную роль в множестве отраслей промышленности и находит применение в различных процессах производства и обработки различных материалов.
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Степень диссоциации H3PO4
Для H3PO4 степень диссоциации зависит от концентрации кислоты и температуры раствора. При комнатной температуре и концентрации 1 М степень диссоциации H3PO4 составляет около 10%. Это означает, что лишь около 10% молекул H3PO4 распадаются на ионы в растворе, а остальные 90% остаются в нераспавшемся виде.
Степень диссоциации H3PO4 можно вычислять с использованием химического равновесия и уравнения реакции диссоциации. В данном случае, у H3PO4 выделяется 3 водородных иона (H+) и один фосфатный ион (PO4^3-). Нижеследующая таблица показывает степень диссоциации в зависимости от концентрации кислоты:
| Концентрация H3PO4, M | Степень диссоциации, % |
|---|---|
| 0.1 | 20 |
| 0.5 | 50 |
| 1 | 10 |
| 5 | 70 |
Степень диссоциации H3PO4 имеет важное значение при использовании этой кислоты в различных промышленных процессах, таких как производство удобрений, пищевая промышленность, производство фосфатных солей и др. Также, степень диссоциации H3PO4 оказывает влияние на окружающую среду, и поэтому важно контролировать выбросы данной кислоты в окружающую среду и обращать внимание на экологические последствия ее использования.
Объяснение понятия «сильная» и «слабая» кислота
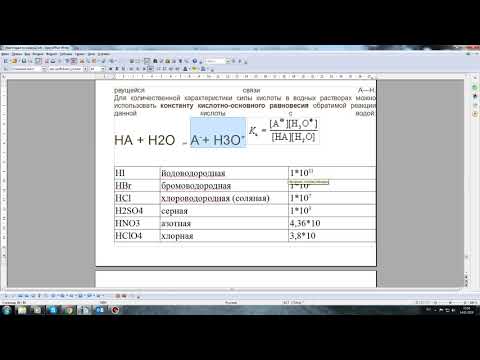
Слабая кислота — это кислота, которая в растворе диссоциирует только частично, оставляя значительное количество недиссоциированных молекул. Такие кислоты имеют низкую степень диссоциации и являются слабыми электролитами.
Степень диссоциации кислоты зависит от ее химической структуры и физических условий, таких как концентрация и температура раствора. Высокая степень диссоциации обусловлена тем, что сильные кислоты имеют слабые связи между атомами водорода и легко отдают ионы H+ в раствор. Слабые кислоты имеют более прочные связи и более сложную структуру.
Однако, важно отметить, что термины «сильная» и «слабая» кислота являются относительными. Кислота может быть сильной в одном контексте и слабой в другом, в зависимости от конкретных условий.
Расчет степени диссоциации H3PO4
Степень диссоциации H3PO4 может быть определена с помощью кислотно-основного равновесия, которое устанавливается при диссоциации кислоты в растворе. Для H3PO4 данное равновесие выглядит следующим образом:
H3PO4 ⇌ H+ + H2PO4-
Где H+ – ион водорода, H2PO4- – ион дигидрофосфата.
Степень диссоциации кислоты определяется по формуле:
α = (c(H+) * V) / c(H3PO4)
Где α – степень диссоциации, c(H+) – концентрация ионов водорода в растворе, V – объем щелочи, необходимый для нейтрализации H3PO4, c(H3PO4) – концентрация исходной кислоты.
Расчет степени диссоциации H3PO4 может быть произведен с использованием экспериментальных данных. Вначале необходимо измерить концентрацию исходной кислоты путем титрования раствора щелочью. Затем, используя объем и концентрацию щелочи и исходной кислоты, можно вычислить степень диссоциации согласно указанной формуле.
Кроме того, степень диссоциации H3PO4 может быть рассчитана с помощью математических моделей, основанных на известных физико-химических параметрах и свойствах раствора кислоты.
Расчет степени диссоциации H3PO4 является важным шагом при изучении ее химических свойств и применении в различных отраслях промышленности. Знание этой величины позволяет оценивать активность кислоты и ее влияние на окружающую среду, а также прогнозировать результаты химических реакций, в которых принимает участие H3PO4.
Видео:Сильные и слабые кислотыСкачать
Влияние H3PO4 на окружающую среду
Прежде всего, при производстве H3PO4 выделяются значительные объемы выбросов в атмосферу. Процесс производства фосфорной кислоты часто сопровождается выбросами оксидов фосфора, которые являются причиной загрязнения воздуха и формирования кислотных дождей. Кроме того, выбросы оксидов фосфора также могут вызывать различные респираторные заболевания и влиять на здоровье людей.
Еще одной проблемой, связанной с использованием H3PO4, является загрязнение водных ресурсов. В процессе производства и использования фосфорной кислоты, могут выпускаться отходы и сточные воды, содержащие различные химические соединения, включая токсичные элементы и ионы фосфора. Эти вещества могут попадать в водоемы и загрязнять воду, что негативно влияет на экосистему и здоровье живых организмов, включая рыб и других водных животных.
Кроме того, использование H3PO4 может приводить к разрушению почвы и снижению её плодородия. Выпадение кислотных дождей, вызванных выбросами оксидов фосфора, способствует уксусному окислению почвы и может снизить её pH. Это может привести к вымыванию питательных веществ из почвы и снижению урожайности сельскохозяйственных культур.
Поэтому, необходимо принимать меры для снижения негативного влияния H3PO4 на окружающую среду. Важно разработать более экологически чистые методы производства фосфорной кислоты, а также эффективные системы очистки выбросов и сточных вод от содержащихся в них загрязнений. Также, следует уделять большее внимание контролю и регулированию выбросов в атмосферу и водные ресурсы, чтобы минимизировать негативные последствия использования H3PO4.
Экологические последствия использования H3PO4
Использование H3PO4 в промышленности может иметь серьезные экологические последствия. Эта кислота обладает кислотными свойствами, что может вызывать коррозию материалов, с которыми она контактирует. При попадании H3PO4 в окружающую среду, она может загрязнять воду, почву и воздух.
H3PO4 является одним из основных источников фосфора в промышленности. Фосфор, который содержится в кислоте, часто используется в производстве удобрений и рыболовецком хозяйстве. Однако, когда H3PO4 выбрасывается в окружающую среду, это может привести к переизбытку фосфора в водных системах.
Избыток фосфора в водных системах может привести к росту водорослей и других растений, что вызывает процесс эутрофикации. Это означает, что водная среда становится избыточно питательной, что может привести к разрастанию водных организмов и нарушению экосистемы. Кроме того, избыток фосфора может привести к образованию вредных веществ, таких как блю-green водоросли и токсичные водоросли, которые могут быть вредными для живых организмов, включая рыб и других водных видов.
Кроме того, при спалении H3PO4 может выделяться диоксид фосфора, который является одним из главных источников загрязнения воздуха. Диоксид фосфора входит в состав атмосферного осадка, который попадает на поверхность земли, и может влиять на качество почвы и воды.
В целом, использование H3PO4 имеет значительное влияние на окружающую среду. Необходимо принимать меры для контроля выбросов в окружающую среду и разработки более эффективных и экологически безопасных альтернативных методов производства и использования фосфорсодержащих продуктов.
📺 Видео
Гидролиз солей. 9 класс.Скачать

Кислоты | Химия ОГЭ 2023 | УмскулСкачать

Фосфорная кислота- кислота, которую все пробовали на вкус (чистую, а не в составе кока колы).Скачать

H3PO4 ступени диссоциация ортофосфорный кислоты❗️Скачать
как определить валентность фосфора в H3PO4Скачать

Серная и азотная кислоты! | Химия ЕГЭ 10 класс | УмскулСкачать

рН слабых кислотСкачать
Химия. 9 класс. Степень диссоциации. Сильные и слабые электролиты /11.09.2020/Скачать

Химическое равновесие. Задание №22 | Химия ЕГЭ 2022 | УмскулСкачать

Ортофосфорная кислота. Соли фосфорной кислоты. 9 класс.Скачать

How to prepare 1M H3PO4 solutionСкачать

How to Find the Number of Atoms in H3PO4 (Phosphoric acid)Скачать

Гидролиз | Химия ЕГЭ | УмскулСкачать

Кислые и основные соли | ЕГЭ по химии | Екатерина СтрогановаСкачать

Making phosphoric acid H3PO4, do not try at homeСкачать

Все ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

СТАРТ ИНТЕНСИВА «XO» | День 1 | Общая химия теория и тестовая часть | Екатерина СтрогановаСкачать

