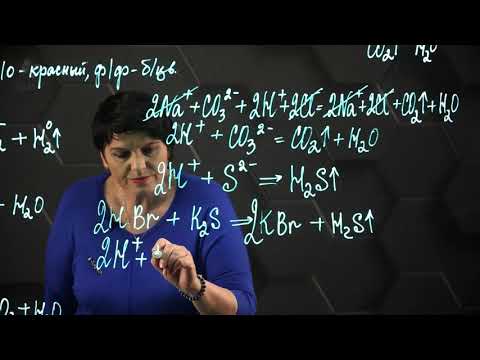Кислоты — это химические соединения, которые обладают рядом уникальных свойств. Они широко распространены в нашей повседневной жизни и играют важную роль в различных сферах деятельности. Кислоты можно найти в продуктах питания, бытовой химии, медицине и промышленности.
Главной характеристикой кислоты является ее способность образовывать водородные ионы при взаимодействии с водой. Это свойство делает их кислотами и определяет большинство их химических реакций. Кислоты могут проявлять как сильные, так и слабые кислотные свойства. Сильные кислоты, например, серная или соляная кислота, полностью диссоциируют в воде и образуют большое количество водородных ионов, в то время как слабые кислоты, такие как уксусная или лимонная кислота, диссоциируют лишь частично, оставляя некоторое количество недиссоциированных молекул.
Кислоты могут оказывать влияние на окружающую среду. Некоторые кислоты, например, серная и азотная кислоты, могут быть растворены в воздухе в виде кислотных дождей. Это создает серьезные проблемы для экологии и здоровья людей, так как кислотные дожди могут повредить растения и источники воды, а также вызывать проблемы с дыханием и аллергией у людей. Поэтому кислоты и их влияние на окружающую среду являются предметом внимания в области экологии и охраны природы.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства кислот: основные характеристики и влияние на окружающую среду
- Кислотность: Одним из главных химических свойств кислот является их кислотность. Кислотность определяется концентрацией и процентным содержанием водородных ионов (H+) в растворе кислоты. Чем больше водородных ионов содержится в растворе, тем кислее он будет.
- pH: pH – это мера кислотности или щелочности раствора, определяемая концентрацией ионов водорода. pH-значение меняется от 0 до 14, где 7 – нейтральное значение, меньше 7 – кислотное значение, а больше 7 – щелочное значение.
- Реакция с металлами: Многие кислоты способны реагировать с металлами, образуя соли и выделяя водородный газ. Например, реакция соляной кислоты (HCl) с цинком (Zn) приводит к образованию хлорида цинка (ZnCl2) и выделению водородного газа (H2).
- Реакция с щелочами: Реакция кислоты с щелочью называется нейтрализацией. В результате нейтрализации образуются соль и вода. Например, реакция соляной кислоты (HCl) с натриевой гидроксидом (NaOH) дает хлорид натрия (NaCl) и воду (H2O).
- Коррозионная активность: Кислоты, особенно сильные, обладают высокой коррозионной активностью и могут разрушать материалы, с которыми контактируют. Например, соляная кислота может разъедать металлы и повреждать структуру бетона.
- Влияние на окружающую среду: Использование кислот может оказывать отрицательное влияние на окружающую среду. Выбросы кислотных газов, таких как сернистый (SO2) и азотистый (NOx) оксиды, в атмосферу приводят к образованию кислотных дождей, которые оказывают разрушительное воздействие на природные экосистемы.
Важно понимать химические свойства и особенности кислот, чтобы правильно использовать их в промышленности, охранять окружающую среду и соблюдать меры безопасности при работе с ними.
Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Определение и классификация кислот
Классификация кислот может осуществляться по различным признакам:
- По происхождению: кислоты могут быть природными или синтетическими.
- По химическим свойствам: кислоты могут быть однократными или многократными в зависимости от числа отданных протонов.
- По степени диссоциации: кислоты могут быть сильными или слабыми в зависимости от их способности отдавать протоны.
- По составу: кислоты могут быть минеральными или органическими в зависимости от элементов, из которых они состоят.
Определение и классификация кислот являются важными вопросами в химии, так как позволяют систематизировать разнообразие кислот и изучать их свойства и реакционную способность. Знание классификации кислот также позволяет проводить анализ и синтез химических соединений, а также прогнозировать их взаимодействие с другими веществами.
Определение и основные свойства кислот
Основные свойства кислот включают:
- Кислотность: Кислоты обладают кислотностью, что означает, что они могут давать протоны (водородные ионы H+). Кислотность вещества определяется его способностью отдавать протоны.
- Кислотные реакции: Кислоты обычно участвуют в реакциях, где они реагируют с щелочами, основаниями и некоторыми металлами. Эти реакции называются кислотно-основными (или реакциями нейтрализации) и часто сопровождаются образованием солей и воды.
- Электролитическое поведение: Кислоты являются электролитами, то есть они разлагаются на ионы в водном растворе и способны проводить электрический ток.
- Свойства растворов: Кислотные растворы имеют характерные свойства, такие как кислотный вкус, способность изменять цвет индикаторов (например, фенолфталеина) и причинять раздражение на коже и слизистых оболочках.
- Коррозийное действие: Некоторые кислоты имеют сильное коррозионное действие на различные материалы, включая металлы, и могут вызывать повреждение и разрушение.
- Специфические свойства: Каждая кислота имеет свои уникальные свойства, например, серная кислота (H2SO4) является сильной кислотой и имеет сульфоокислительные свойства.
Основные свойства кислот определяют их роль и применение в различных областях науки и технологии, включая химическую промышленность, медицину, пищевую промышленность и другие.
Классификация кислот по их происхождению
Кислоты могут быть различного происхождения в зависимости от их источника или способа получения. Вот несколько основных типов кислот, классифицированных по их происхождению:
- Органические кислоты.
- Неорганические кислоты.
- Минеральные кислоты.
- Аминокислоты.
- Сильные и слабые кислоты.
Органические кислоты происходят от органических соединений, содержащих одну или более кислородных групп. Примерами органических кислот являются уксусная кислота (CH₃COOH), лимонная кислота (C₆H₈O₇) и множество других кислот, которые встречаются в природе или используются в промышленности.
Неорганические кислоты обычно не содержат карбонильных групп и происходят от неорганических соединений. Примерами неорганических кислот являются соляная кислота (HCl), серная кислота (H₂SO₄) и азотная кислота (HNO₃).
Минеральные кислоты являются подтипом неорганических кислот и обладают высокой кислотностью и реактивностью. Они получаются из различных минералов или полезных ископаемых и широко используются в промышленности и лабораториях. К ним относятся серная кислота, фосфорная кислота, соляная кислота и другие.
Аминокислоты являются основными структурными блоками белков и важными молекулами в живых организмах. Они содержат как кислотную, так и аминную группы. Некоторые известные аминокислоты включают глутаминовую кислоту, глицин и лейцин.
Кислоты можно также классифицировать как сильные или слабые в зависимости от их реактивности и способности отдавать ионы в растворе. Сильные кислоты, такие как серная кислота или хлороводородная кислота, полностью диссоциируют в воде, образуя большое количество ионов водорода (H+). Слабые кислоты, такие как уксусная кислота или молочная кислота, диссоциируются только частично, образуя меньшее количество ионов водорода.
Классификация кислот по их происхождению помогает понять их свойства, реактивность и влияние на окружающую среду. Разные типы кислот имеют различные применения и важность в различных отраслях промышленности, медицине и науке.
Классификация кислот по их химическим свойствам
По кислотности:
Кислоты могут быть сильными или слабыми в зависимости от своей способности отдавать протоны. Сильные кислоты (например, серная кислота) полностью диссоциируют в водном растворе, отдавая все свои протоны. Слабые кислоты (например, уксусная кислота) диссоциируют лишь частично, отдавая некоторую часть своих протонов.
По числу протонов:
Кислоты также могут быть моно-, двух- или многоосновными, в зависимости от количества протонов, которые они могут отдать. Моноосновные кислоты (например, соляная кислота) могут отдать лишь один протон, двухосновные кислоты (например, серная кислота) — два протона, а многоосновные кислоты (например, фосфорная кислота) — более двух протонов.
По структуре:
Кислоты можно разделить на неорганические и органические. Неорганические кислоты (например, серная кислота) имеют неорганическую структуру и обычно получаются из неорганических соединений. Органические кислоты (например, уксусная кислота) содержат углерод и образуются в результате метаболизма организмов.
Таким образом, классификация кислот по их химическим свойствам позволяет нам лучше понять их природу и реакционную способность. Это знание важно для понимания влияния кислот на окружающую среду и применения их в различных областях науки и промышленности.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Основные химические свойства кислот
Одной из основных химических свойств кислот является их способность реагировать с основаниями, образуя соли и воду. Это реакция называется нейтрализацией и обычно сопровождается выделением тепла и образованием ионов водорода или гидроксид-ионов.
Кислоты также обладают коррозионными свойствами и могут разрушать различные материалы, включая металлы и камень. Например, сильные минеральные кислоты, такие как серная или азотная кислота, могут атаковать металлы и вызывать их окисление или растворение.
Другое важное химическое свойство кислот — их способность изменять цвет индикаторов. Многие кислоты реагируют с индикаторами, такими как фенолфталеин или лакмусовая бумага, и изменяют их цвет в зависимости от уровня pH раствора. Например, кислотный раствор обычно окрашивает лакмусовую бумагу в красный цвет.
Важно отметить, что химические свойства кислот могут варьировать в зависимости от их концентрации, температуры и других условий реакции. Некоторые кислоты могут быть сильными, проявляя ярко выраженные химические свойства, в то время как другие могут быть слабыми и проявлять меньшую активность.
| Основные химические свойства кислот |
|---|
| Образование ионов водорода (H+) |
| Возможность отдачи ионов водорода другим субстанциям |
| Реакция с основаниями |
| Коррозионные свойства |
| Изменение цвета индикаторов |
Кислотность и pH
Однако явное значение концентрации H+ ионов неудобно для практического измерения и анализа. Для удобства была введена величина pH, которая позволяет измерить кислотность раствора. pH определяется как отрицательный логарифм по основанию 10 от концентрации H+ ионов.
pH шкала имеет диапазон от 0 до 14. Если pH около 7, то раствор считается нейтральным, если pH меньше 7, то раствор считается кислым, а если pH больше 7, то раствор считается щелочным или щелочным.
pH является важным параметром при регулировании окружающей среды и влияет на живые организмы. Например, различные организмы требуют определенного pH для нормального функционирования своих систем.
Кислотность и pH имеют важные применения в различных отраслях, таких как химическая промышленность, медицина, пищевая промышленность и экология. Они помогают контролировать и регулировать процессы, происходящие в растворах, и определять их влияние на окружающую среду, а также организмы, с которыми контактируют эти растворы.
В совокупности, кислотность и pH играют ключевую роль в понимании и изучении свойств кислот и их влиянии на окружающую среду. Эти понятия также имеют практическое значение и широко применяются в различных научных и производственных областях.
🎬 Видео
ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Свойства кислот и их применение. 8 класс.Скачать

Кислоты | Химия ОГЭ 2023 | УмскулСкачать

Кислоты. 8 класс.Скачать

Химия 8 класс (Урок№20 - Получение и химические свойства кислот.)Скачать

47. Химические свойства кислотСкачать

Действие кислот на индикаторыСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические свойства кислот. 7 класс.Скачать

КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

4.1 Кислоты и щелочи | Химия вокруг насСкачать

Химические свойства кислот. ЭкспериментСкачать

Химические свойства кислот | ХимияСкачать

Классификация и химические свойства кислот за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

Габриелян О. С. 8 класс §39 "Кислоты, их классификация и свойства".Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать