Ионная сила раствора – это важное понятие в химии, которое определяет общую концентрацию ионов в растворе. Она играет ключевую роль в химических реакциях и имеет особое значение для понимания различных свойств растворов. Ионная сила раствора является мерой силы электрического поля, создаваемого ионами в растворе.
Понять суть ионной силы раствора поможет знание основ химических реакций и структуры атома. Как известно, все вещества состоят из атомов, которые взаимодействуют между собой, создавая различные соединения и вещества. Под действием различных факторов, таких как температура или давление, атомы могут избывать или получать электроны, становясь ионами.
Ион — это атом или молекула, имеющая электрический заряд. Отрицательно заряженные ионы называются анионами, а положительно заряженные — катионами. Именно силы притяжения и отталкивания между ионами и обуславливают ионную силу раствора. Она зависит от концентрации ионов и их зарядов. Чем больше концентрация и заряд ионов, тем выше ионная сила раствора.
Видео:Практическое занятие. Ионная сила раствораСкачать
Ионная сила раствора: основы и принципы
Ионная сила раствора определяется суммой произведений зарядов ионов на их концентрации. Чем больше заряд иона, тем сильнее он влияет на ионную силу раствора. Кроме того, чем выше концентрация ионов, тем сильнее влияние на ионную силу.
Ионная сила раствора также связана с ионным равновесием. В растворе ионы могут образовывать связи с молекулами других веществ или разделяться на свободные ионы. Ионная сила зависит от равновесия между этими процессами.
Знание ионной силы раствора позволяет определить направление химических реакций и наличие осадков, когда два раствора смешиваются. Также она может быть использована для расчетов электрохимических явлений, таких как окислительно-восстановительные реакции или электролиз.
Итак, ионная сила раствора является ключевым понятием в химии и позволяет предсказать и объяснить различные химические явления в растворе. Понимание основ и принципов ионной силы раствора позволяет более глубоко изучать физико-химические свойства веществ и их взаимодействие в растворах.
Видео:Ионная сила раствора. Теория (кратко) + задача.Скачать

Что такое ионная сила раствора
Ионная сила раствора зависит от концентрации ионов в растворе и их заряда. Чем выше концентрация ионов и больше их заряд, тем выше будет ионная сила раствора.
Определение ионной силы происходит на основе принципа ионного равновесия в растворе. Этот принцип заключается в том, что при достижении равновесия концентрация ионов в растворе остается постоянной.
Зная концентрацию ионов в растворе и их заряд, можно вычислить ионную силу с помощью соответствующих математических формул. Обычно она выражается в мольных единицах, например, моль на литр (M).
Ионная сила раствора имеет большое значение в химии и физико-химических исследованиях. Она позволяет оценить активность ионов в растворе и прогнозировать химические реакции и физико-химические свойства растворов.
Например, зная ионную силу раствора, можно предсказать его электропроводность, растворимость солей и многие другие свойства.
Определение ионной силы
Ионная сила раствора основана на принципе ионного равновесия. Когда в растворе находятся ионы разных зарядов, они взаимодействуют друг с другом, образуя электрически нейтральные соединения или ионные ассоциации.
Ионная сила раствора зависит от концентрации ионов в растворе. Чем выше концентрация ионов, тем выше ионная сила.
Также, ионная сила зависит от заряда ионов. Чем выше заряд ионов, тем выше ионная сила. Например, один моль ионов с зарядом +1 будет иметь большую ионную силу, чем один моль ионов с зарядом +2.
Ионная сила раствора играет важную роль в химических реакциях, так как она влияет на скорость и направление реакции. Кроме того, ионная сила помогает определить растворность солей и предсказать образование осадков при смешивании растворов.
Таким образом, понимание ионной силы раствора является важным для изучения химических процессов и позволяет детально анализировать реакции и взаимодействие между ионами в растворах.
Ионное равновесие в растворе
В ионном равновесии концентрации ионов в растворе остаются постоянными благодаря противоположным реакциям диссоциации и рекомбинации. Таким образом, в растворе существует баланс между образованием ионов из молекул электролита и их возвращением к молекулам.
Ионное равновесие зависит от различных факторов, таких как температура, концентрация электролитов и pH раствора. Задавая определенные условия, можно изменять ионное равновесие и контролировать химические процессы в растворе.
Важно отметить, что ионное равновесие может быть сдвинуто вправо или влево, в зависимости от факторов, влияющих на диссоциацию и рекомбинацию ионов. Например, изменение pH раствора может повлиять на ионное равновесие, поскольку концентрация ионов в растворе зависит от pH.
Ионное равновесие в растворе является фундаментальным понятием для понимания химических реакций и свойств растворов. Оно позволяет изучать поведение ионов и предсказывать результаты химических процессов.
Источники:
1. Рейнхардт Л. Моль и молекулярный мир. Киев: Академия, 2013.
2. Джонс Р. Ионный баланс и химические реакции. Москва: Издательство «Лаборатория знаний», 2012.
Видео:Задача. Ионная сила, активность ионовСкачать

Принципы ионной силы раствора
Принципы ионной силы раствора основаны на следующих законах:
- Закон Дебая-Хюккеля. Этот закон устанавливает, что ионная сила раствора прямо пропорциональна квадратному корню из произведения концентраций ионов и обратно пропорциональна квадратному корню из диэлектрической проницаемости раствора.
- Закон Вант-Гофа. Этот закон утверждает, что ионная сила раствора зависит от суммы зарядов всех ионов, находящихся в растворе. Чем больше заряды ионов, тем выше ионная сила раствора.
- Закон активности. Согласно этому закону, ионная сила раствора определяется активностью ионов, которая зависит от их концентрации и активности.
Принципы ионной силы раствора имеют важное значение в химических и физических процессах, касающихся электролитов и растворов. Они помогают понять термодинамические свойства растворов, а также предсказывать результаты различных химических реакций.
Знание принципов ионной силы раствора может быть полезно при проведении лабораторных исследований, разработке новых материалов и процессов, а также при оптимизации условий реакций для достижения желаемых результатов.
Влияние концентрации ионов на ионную силу
Концентрация ионов в растворе имеет значительное влияние на ионную силу. Чем выше концентрация ионов, тем выше ионная сила раствора. Это объясняется тем, что большое количество ионов в растворе создает более интенсивные электростатические взаимодействия между ними.
Повышение концентрации ионов может привести к увеличению ионной силы раствора в несколько раз. Например, если в растворе содержится большое количество ионов натрия, то ионная сила этого раствора будет выше, чем у раствора с низкой концентрацией ионов натрия.
Однако следует отметить, что концентрация ионов в растворе не является единственным фактором, определяющим ионную силу. Помимо концентрации, важную роль играют также заряд ионов и их тип.
Таким образом, влияние концентрации ионов на ионную силу является одним из основных факторов, определяющих степень электростатического взаимодействия между ионами в растворе.
Зависимость ионной силы от заряда ионов
Для понимания этой зависимости необходимо учесть, что ионная сила раствора является суммой произведений зарядов всех ионов, присутствующих в растворе, умноженных на их концентрации. Таким образом, ионы с более высоким зарядом будут иметь больший вклад в общую ионную силу по сравнению с ионами с меньшим зарядом.
Примером может служить сравнение ионов кальция (Ca2+) и натрия (Na+). Кальций имеет заряд +2, а натрий — +1. Если концентрации этих ионов одинаковы, то ионная сила, вызванная кальцием, будет в два раза больше, чем вызванная натрием. Это связано с тем, что кальций имеет двойной заряд по сравнению с натрием.
Таким образом, заряд иона напрямую влияет на его вклад в ионную силу раствора. Чем выше заряд иона, тем сильнее его вклад в общую ионную силу. Это свойство позволяет учитывать заряд ионов при анализе ионных растворов и прогнозировать их поведение и свойства.
🔍 Видео
Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Ионное произведение воды. Водородный показатель. 11 класс.Скачать

Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Твёрдый раствор. Закон РауляСкачать

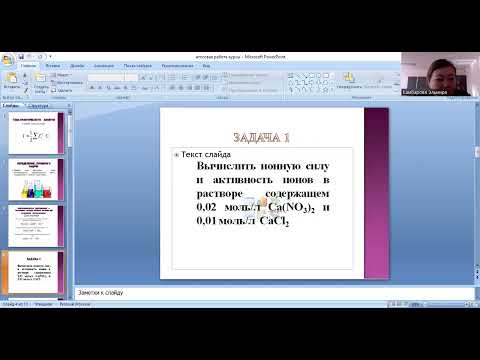
Задача1Скачать

Равновесие в растворе роданида железаСкачать

Реакции ионного обмена. 9 класс.Скачать

сильные и слабые электролиты РАСЧЕТ рНСкачать

Химическая радуга, создание семи цветных растворов. (химия)Скачать

75. Ионные реакции в растворах электролитовСкачать

задачи на коллигативные свойстваСкачать

Лекция 3 Механизмы образования растворов электролитовСкачать

Приготовление стандартного раствораСкачать

Лекция 3Скачать

Растворы электролитовСкачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

