Инертные газы — это группа веществ, которые отличаются от остальных химических элементов своим невосприимчивым характером. Долгое время считалось, что эти газы, такие как аргон, криптон, ксенон и радон, полностью бесполезны и безвредны для человека и окружающей среды. Однако в последние десятилетия наука открыла ряд удивительных свойств и применений инертных газов, которые делают их по-настоящему благородными веществами.
Одним из наиболее важных качеств инертных газов является их стабильность и безопасность. Они являются нереактивными и не образуют соединений с другими веществами при обычных условиях. Это делает их идеальными для использования в различных индустриальных процессах и технологиях. Например, аргон применяется в промышленности для защиты металлов от окисления. Криптон и ксенон используются в осветительных приборах, благодаря своей способности к эмиссии яркого света.
Кроме своей химической инертности, инертные газы также показывают ряд физических особенностей, которые делают их уникальными веществами. Они обладают высокой плотностью и плотностью массы, что позволяет им использоваться в различных приборах и аппаратах. Инертные газы также обладают низкой теплопроводностью и высокой теплостойкостью, что делает их незаменимыми для использования в высокотемпературных процессах, таких как плавка металлов и кристаллизация материалов.
- Влияние свойств инертных газов на их благородность
- Факторы, обуславливающие благородность инертных газов
- Электронная конфигурация газов
- Валентная оболочка элементов
- Процессы, приводящие к благородности инертных газов
- 7. Взаимодействие инертных газов с другими элементами
- Стабильность атомов инертных газов — одна из причин их благородности
- Высокая ионизационная энергия газов
- 📽️ Видео
Видео:Благородные газы и их свойстваСкачать

Влияние свойств инертных газов на их благородность
Инертные газы, также известные как благородные газы, обладают особыми свойствами, которые делают их уникальными и ценными. Они включают в себя элементы группы 18 (VIIIA) периодической системы, такие как гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn).
Свойства инертных газов, такие как невосприимчивость к химическим реакциям и высокая стабильность, являются основными причинами их благородности. Инертные газы обычно не образуют соединений с другими элементами, что делает их чрезвычайно устойчивыми и некоторым образом отделенными от внешнего воздействия.
Эти свойства благородных газов связаны с их электронной конфигурацией и валентной оболочкой элементов. Инертные газы имеют полностью заполненные энергетические уровни с неподвижными электронами, что делает их малоактивными и неспособными к образованию химических связей или реакций.
| Элемент | Электронная конфигурация | Валентная оболочка |
|---|---|---|
| Гелий (He) | 1s2 | 2 |
| Неон (Ne) | [He] 2s2 2p6 | 8 |
| Аргон (Ar) | [Ne] 3s2 3p6 | 8 |
| Криптон (Kr) | [Ar] 3d10 4s2 4p6 | 8 |
| Ксенон (Xe) | [Kr] 4d10 5s2 5p6 | 8 |
| Радон (Rn) | [Xe] 4f14 5d10 6s2 6p6 | 8 |
Взаимодействие инертных газов с другими элементами или соединениями редко происходит из-за их низкой реакционной способности. Эти газы имеют высокую ионизационную энергию, что обуславливает их стабильность и отсутствие стремления образовывать химические связи.
Благодаря своей благородности, инертные газы нашли широкое применение в различных областях науки и технологии, включая заполнение ламп, защиту сварочных процессов, использование в ионных двигателях и в качестве хладагентов.
Видео:Благородные газы и с чем это едятСкачать

Факторы, обуславливающие благородность инертных газов
Благородность инертных газов обусловлена несколькими факторами, которые делают их химически нереактивными и малоактивными. Эти факторы включают в себя:
- Электронная конфигурация газов: Инертные газы имеют полностью заполненные электронные оболочки, что делает их электронно стабильными. Количество электронов в валентной оболочке инертных газов достигает максимального значения, что приводит к низкой реактивности.
- Валентная оболочка элементов: Инертные газы имеют полностью заполненные s и p оболочки, что является одной из причин их благородности. Это означает, что у них достигнуто оптимальное распределение электронов и энергия в системе, что делает их мало склонными к реакциям.
- Процессы, приводящие к благородности инертных газов: Один из процессов, который оказывает влияние на благородность инертных газов, — это процесс ионизации. Инертные газы обладают очень высокой ионизационной энергией, что затрудняет удаление электрона из атома. Это делает их неспособными образовывать стабильные ионы и участвовать в химических реакциях.
- Взаимодействие с другими элементами: Инертные газы не проявляют активность по отношению к другим элементам в обычных условиях. Их продуктивное взаимодействие с другими элементами требует высокой энергии и особых условий, что является редким и исключительным явлением.
- Стабильность атомов газов: Инертные газы имеют стабильные атомы, что делает их устойчивыми и некислотными. Их электронное строение и отсутствие свободных электронов в валентной оболочке препятствуют реакциям с другими веществами, включая кислоты.
- Высокая ионизационная энергия газов: Инертные газы обладают очень высокой ионизационной энергией, что делает их атомы стабильными и малоактивными. Их электроотрицательность низкая, что делает их слабыми окислителями и неподходящими для реакций с другими веществами.
Эти факторы в совокупности приводят к тому, что инертные газы, такие как гелий, неон, аргон, криптон и ксенон, становятся благородными и малоактивными, что делает их полезными для различных приложений в науке, промышленности и технологии.
Электронная конфигурация газов
Конкретно, инертные газы имеют заполненную внешнюю энергетическую оболочку, известную как валентная оболочка, и не имеют свободных электронов для образования химических связей с другими атомами. К примеру, атом гелия имеет два электрона в своей валентной оболочке, которая является полностью заполненной и электронейтральной. Это делает гелий абсолютно стабильным и неподверженным реакциям с другими элементами.
Из-за своей полностью заполненной электронной конфигурации, инертные газы обладают высокой энергией ионизации. Это означает, что им требуется большое количество энергии для удаления электрона из их валентной оболочки. Поэтому, инертные газы редко образуют ионы, и их атомы остаются стабильными и неподвижными.
Валентная оболочка элементов
У инертных газов, таких как гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn), валентная оболочка содержит полное число электронов, что делает их стабильными и малоактивными химически.
| Элемент | Атомный номер | Число электронов в валентной оболочке |
|---|---|---|
| Гелий (He) | 2 | 2 |
| Неон (Ne) | 10 | 8 |
| Аргон (Ar) | 18 | 8 |
| Криптон (Kr) | 36 | 8 |
| Ксенон (Xe) | 54 | 8 |
| Радон (Rn) | 86 | 8 |
Из таблицы видно, что валентная оболочка инертных газов всегда содержит 8 электронов, кроме гелия, у которого таких электронов всего 2. Это объясняет их малую реактивность, поскольку у этих элементов нет потребности ни в отдаче, ни в принятии электронов от других элементов для заполнения валентной оболочки.
Благодаря полностью заполненной валентной оболочке, инертные газы обладают высокой стабильностью и низкой энергией взаимодействия с другими атомами. Это делает их неподверженными химическим реакциям и взаимодействию с большинством других веществ. Благодаря этим свойствам, инертные газы получили название «благородных» газов.
Видео:Почему некоторые газы называют благородными.Скачать

Процессы, приводящие к благородности инертных газов
Взаимодействие с другими элементами играет важную роль в формировании благородности инертных газов. Они проявляют очень низкую реактивность и практически не образуют химических соединений с другими элементами. Это связано с их внешней электронной конфигурацией, которая уже полностью заполнена и стабильна.
Стабильность атомов инертных газов обусловлена высокой энергией связи между их атомами. Это делает их мало склонными к реакциям и более устойчивыми в химических условиях. Их атомы не стремятся получить или отдать электроны, чтобы достигнуть стабильной электронной конфигурации.
Кроме того, инертные газы характеризуются высокой ионизационной энергией, т.е. энергией, необходимой для удаления электрона из атома. Ионизационная энергия инертных газов значительно выше, чем у других элементов. Это делает их более устойчивыми и менее подверженными химическим реакциям.
Все эти факторы, в совокупности, обуславливают благородность инертных газов. Они не только не вступают в химические реакции, но и демонстрируют высокую стойкость к окружающим условиям. Благодаря этим свойствам они широко используются в различных промышленных и научных приложениях, а также как инертные среды при проведении экспериментов и реакций с высокой температурой или высоким давлением.
7. Взаимодействие инертных газов с другими элементами
Взаимодействие инертных газов с другими элементами обычно происходит при высоких температурах и высоком давлении, а также в результате электрического разряда или других экстремальных условий.
Одним из важных аспектов взаимодействия инертных газов с другими элементами является их способность выступать в качестве инертного газового слоя, оберегающего поверхность материала от нежелательной реакции с окружающей средой. Некоторые инертные газы, такие как аргон и гелий, используются в процессе сварки для защиты сварочного шва от окисления и загрязнения.
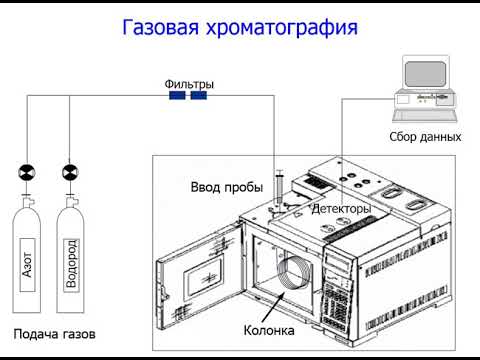
Кроме того, инертные газы могут использоваться как разрядная среда или газовый растворитель для проведения различных химических реакций. Например, ксенон и неон широко применяются в лазерных технологиях, а гелий используется в газовых хроматографах для разделения и анализа соединений.
Взаимодействие инертных газов с другими элементами может также происходить в природных условиях. Например, атмосфера Земли содержит около 1% аргона, который образуется в результате распада радона и выходит в атмосферу из горных пород. Кроме того, хелий, который является вторым по распространенности элементом во Вселенной, образуется при реакциях внутри звезд и может быть обнаружен в земных газовых месторождениях.
Стабильность атомов инертных газов — одна из причин их благородности
Конфигурация электронов инертных газов характеризуется тем, что энергетические уровни s и p подуровней в их валентной оболочке заполнены правильно. Например, у атома аргон из 18 электронов, при заполнении внутренних энергетических уровней, в его валентной оболочке находятся 8 электронов. Полностью заполненные подуровни приводят к высокой стабильности атомов инертных газов.
| Название газа | Атомная структура |
|---|---|
| Гелий (He) | 1s2 |
| Неон (Ne) | 1s2 2s2 2p6 |
| Аргон (Ar) | 1s2 2s2 2p6 3s2 3p6 |
| Криптон (Kr) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 |
| Ксенон (Xe) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 |
| Радон (Rn) | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 |
Высокая стабильность атомов инертных газов является причиной того, что они не проявляют химических реакций с другими элементами при нормальных условиях. Такие атомы обладают насыщенной электронной оболочкой и не имеют незаполненных энергетических уровней, которые требуются для образования химических связей с другими атомами. Благодаря этому, инертные газы обладают высокой химической инертностью и неактивностью.
Высокая ионизационная энергия газов
Инертные газы, такие как гелий, неон, аргон, криптон, ксенон и радон, имеют очень высокие значения ионизационной энергии. Это означает, что эти газы трудно ионизировать и формировать положительные ионы. Они обладают полностью заполненной валентной оболочкой электронов, что делает их стабильными и мало реактивными.
Высокая ионизационная энергия газов обусловлена их электронной конфигурацией. На внешней оболочке инертных газов находятся уже максимальное количество электронов, и добавление или удаление электрона требует значительной энергии.
Благодаря высокой ионизационной энергии, инертные газы остаются стабильными и не образуют химических соединений с другими элементами без значительного внешнего воздействия или высоких энергетических условий.
Эта особенность инертных газов является причиной их использования в различных областях, включая науку, промышленность и медицину. Например, аргон используется в заполнении ламп накаливания и сварочных аппаратах, так как его стабильность и неподвижность делает его идеальным газом для создания контролируемой окружающей среды.
Таким образом, высокая ионизационная энергия инертных газов играет важную роль в их благородности и обуславливает их уникальные химические свойства.
📽️ Видео
Инертные газыСкачать

Химия благородных газов — Артем ОгановСкачать

Благородные газыСкачать
Аргон - Инертный Газ, Расплавляющий Металлы!Скачать

История открытия благородных газовСкачать

ВЫПУСК №24 - ХИМИЯ ИНЕРТНЫХ ГАЗОВСкачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Tanker Inert Gas System. Система инертного газа на танкере #tanker #magellanseamanСкачать

Система Инертного Газа на Танкере. Inert Gas SystemСкачать

Гелий - Сверхтекучий и Самый ХОЛОДНЫЙ элемент!Скачать

Неон - самый ИНЕРТНЫЙ газ на ЗЕМЛЕ!Скачать

Закономерность изменения свойств элементов в периодах и группах. 10 класс.Скачать

Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]Скачать
![Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]](https://i.ytimg.com/vi/N5xnKLO8j4Y/0.jpg)
Абдулгазиев Ислям Свечение инертных газовСкачать

Инертные газы Фастовский Ровинский ПетровскийСкачать

Пирогов А.В. Газовая хроматографияСкачать