В системе газа равновесное состояние является желаемым результатом, когда все параметры системы стабилизируются и остаются неизменными со временем. Достижение равновесия в газовой системе основывается на принципах термодинамики и определенных условиях, которые необходимо соблюдать.
Основными принципами достижения равновесия в системе газа являются законы сохранения энергии и массы. С помощью принципа сохранения энергии можно определить, как энергия в системе перераспределяется и превращается из одной формы в другую. Принцип сохранения массы позволяет определить, как масса газа в системе остается постоянной при его переходе из одного состояния в другое.
Одним из основных условий достижения равновесного состояния в газовой системе является отсутствие внешних воздействий. Это означает, что газ должен находиться в закрытом контейнере, чтобы предотвратить потерю или добавление массы. Кроме того, система должна быть изолирована от внешней среды, чтобы предотвратить тепловой обмен с окружающей средой.
Другим важным условием достижения равновесия в газовой системе является свободное перемешивание молекул газа. Благодаря свободному движению газовых молекул, они могут равномерно распределиться в системе, достигая равновесного состояния. Это позволяет достичь равновесия как в отношении температуры и давления, так и в отношении концентрации компонентов газовой смеси.
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Как достичь равновесного состояния в системе газа
Равновесное состояние в системе газа может быть достигнуто при определенных условиях и соблюдении основных принципов. Рассмотрим этот процесс более подробно.
- Распределение частиц и энергии.
- Взаимодействие между частицами.
- Границы системы.
- Условия равновесия.
В газе частицы находятся в постоянном движении и обладают кинетической энергией. Распределение частиц и энергии в системе газа играет важную роль в достижении равновесия. Чтобы достичь равноправного распределения, необходимо обеспечить равенство давления и плотности во всей системе.
В системе газа взаимодействие между частицами играет решающую роль в достижении равновесия. Взаимодействие обусловлено силами притяжения и отталкивания между частицами. Знание и понимание этих сил позволяют контролировать и управлять равновесным состоянием системы газа.
Система газа имеет определенные границы, которые могут быть открытыми или закрытыми. Важно учитывать влияние границ системы на достижение равновесия. Открытые границы позволяют частицам взаимодействовать с внешней средой, в то время как закрытые границы ограничивают взаимодействия только внутри системы.
Для достижения равновесного состояния в системе газа необходимо соблюдать определенные условия. Одним из таких условий является отсутствие изменения общей энергии системы газа. Кроме того, необходимо достичь равенства давления и плотности частиц, а также обеспечить стабильность и равномерность распределения частиц в объеме системы.
Теперь, зная основные принципы и условия, мы можем более эффективно управлять состоянием системы газа и достигать равновесия. Равновесное состояние обеспечивает устойчивость и гармоничное функционирование системы, что является важным для многих процессов и приложений.
Видео:Термодинамические системы, параметры. Равновесное, неравновесное состояния терм. систем. 10 класс.Скачать

Основные принципы равновесия в системе газа
Основными принципами, которые обеспечивают равновесие в системе газа, являются:
| Принцип | Описание |
|---|---|
| Закон сохранения энергии | Энергия в системе газа сохраняется и не может быть создана или уничтожена. Это означает, что все изменения в системе должны соответствовать законам сохранения энергии. |
| Закон сохранения массы | Масса газа в системе сохраняется и не может быть создана или уничтожена. Любые изменения в системе должны соблюдать закон сохранения массы. |
| Закон сохранения импульса | Импульс системы газа сохраняется и не может быть создан или уничтожен. Это означает, что любые изменения в системе должны соблюдать закон сохранения импульса. |
Другим важным фактором, влияющим на равновесие в системе газа, является взаимодействие между частицами. Частицы газа взаимодействуют друг с другом и с окружающей средой с помощью различных сил, таких как электростатические силы притяжения и отталкивания.
Также важным условием равновесия в системе газа является наличие границы системы. Граница системы определяет ее размеры и форму, и она может быть открытой или закрытой. Граница системы контролирует поток вещества и энергии между системой и окружающей средой.
В конечном итоге, для достижения равновесного состояния в системе газа, необходимо соблюдать все указанные принципы и условия. Также важно учитывать температуру системы, которая играет роль в распределении энергии между частицами газа.
Распределение частиц и энергии
Равновесное состояние газа зависит от распределения частиц и энергии в системе. При достижении равновесия, частицы газа распределяются равномерно по всему объему и, следовательно, обеспечивают одинаковую плотность газа во всех его точках.
Равномерное распределение частиц происходит благодаря движению молекул газа. Если молекулы имеют высокую скорость, они могут преодолеть силы притяжения друг к другу и перемещаться в другие области газовой системы. Таким образом, совокупное движение частиц обеспечивает равномерное распределение газа по объему.
Кроме того, равномерное распределение частиц газа связано с их энергией. Каждая молекула газа обладает определенной кинетической энергией, которая определяется ее скоростью. В равновесном состоянии, средняя кинетическая энергия молекул во всей системе будет одинаковой.
Распределение энергии между молекулами газа происходит благодаря их столкновениям. Когда молекулы сталкиваются, они могут передавать энергию друг другу. Эти столкновения случайны, и поэтому энергия распределяется равномерно по всей системе газа.
Итак, основными принципами равновесного состояния газа являются равномерное распределение частиц и энергии в системе. Этот процесс зависит от движения молекул газа и их столкновений друг с другом.
Взаимодействие между частицами
Основными видами взаимодействий между частицами в газе являются притяжение и отталкивание. Эти взаимодействия возникают из-за сил притяжения между зарядами частиц и их массы.
Притяжение между частицами приводит к их сближению, а отталкивание – к их отдалению друг от друга. В результате этих взаимодействий, частицы газа постоянно меняют свою скорость и направление движения.
Взаимодействие между частицами также связано с их энергией. При сближении частиц, энергия системы увеличивается, а при отдалении – уменьшается. В равновесном состоянии газа, энергия системы остается постоянной и равномерно распределена между частицами.
Важным фактором взаимодействия между частицами в газе является физическое состояние газа. В зависимости от температуры и давления, это состояние может быть газообразным, жидким или твердым.
Помимо физического состояния, взаимодействие между частицами зависит от структуры и химического состава газа. Например, водородные и кислородные молекулы могут образовывать воду, что изменяет их взаимодействие друг с другом.
Исследование взаимодействия между частицами в газе является важным для понимания его свойств и поведения. Знание этих факторов позволяет контролировать и управлять процессами, связанными с газами, например, в промышленности, научных исследованиях и других сферах деятельности.
Границы системы
Границы системы играют важную роль в достижении равновесного состояния в системе газа. Систему газа можно представить как замкнутую область пространства, в которой находятся все его частицы. Границы могут быть различными: от физических преград, таких как стены или контейнеры, до условных линий, которые определяют пространство, в котором происходят все процессы.
Важно помнить, что границы системы влияют на распределение частиц и энергии. Если границы жесткие и непроницаемые, то частицы не могут покинуть систему, а энергия не может быть передана наружу. В таких условиях система может находиться в равновесии, если силы, действующие на частицы, сбалансированы.
Однако, если границы системы имеют определенную проницаемость или подвижность, то частицы могут взаимодействовать с внешней средой, а энергия может поступать извне. В этом случае равновесие становится сложнее, так как какое-то количество частиц или энергии может уходить или поступать в систему.
Равновесное состояние системы газа зависит от взаимодействия частиц между собой и с границами системы. Взаимодействие между частицами определяет, как они распределяются в пространстве и как они обмениваются энергией. Границы системы могут ограничивать перемещение частиц, что влияет на их распределение и скорость движения. Иногда границы системы могут быть полупрозрачными или даже изменяться со временем, что создает дополнительные условия для достижения равновесия.
В общем, границы системы играют важную роль в достижении равновесного состояния в системе газа. Они определяют, как частицы распределены и как они взаимодействуют между собой. Учет границ системы является важным аспектом в изучении равновесия, так как их свойства и условия определяют поведение системы и позволяют понять, каким образом достичь стабильного состояния.
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Условия равновесия в системе газа
Для достижения равновесного состояния в системе газа необходимо соблюдение определенных условий. Они включают в себя следующие аспекты:
1. Равномерное распределение частиц и энергии:
В равновесной системе газа частицы должны быть равномерно распределены по объему. Это означает, что вероятность нахождения частицы в любом месте системы должна быть одинаковой. Кроме того, энергия частиц должна быть равномерно распределена, чтобы поддерживать стабильное термодинамическое равновесие.
2. Взаимодействие между частицами:
В равновесной системе газа существует межчастичное взаимодействие, которое регулируется правилами молекулярного движения. Это взаимодействие влияет на перемещение и коллизии между частицами. В равновесии частицы не должны испытывать силы, вызывающей ускорение, и перемещаться без какого-либо предпочтительного направления.
3. Границы системы:
Равновесная система газа должна быть ограничена границами, которые могут быть открытыми или закрытыми. Открытые границы позволяют обмену частиц и энергии с окружающей средой. Закрытые границы же не позволяют такому обмену, что может привести к изменению условий равновесия.
Условия равновесия в системе газа являются основополагающими принципами термодинамики и важными для понимания поведения газовых систем. Их соблюдение позволяет достигать стабильного и устойчивого равновесия, при котором частицы газа и его энергия сохраняются в состоянии относительной статической равновесия.
Условия равновесия — Температура
При достижении равновесия в системе газа температура остается постоянной и одинаковой для всех частиц. Это значит, что суммарная кинетическая энергия частиц в системе газа не меняется и остается постоянной. Такая стабильность температуры обеспечивает равновесное состояние системы.
Следует отметить, что температура может влиять на распределение частиц и энергии в системе газа. При повышении температуры частицы начинают двигаться быстрее, поэтому их энергия увеличивается. Это может привести к увеличению давления и объема системы, а также к изменению плотности газа.
Определение температуры в системе газа может осуществляться с помощью различных приборов и методов, включая термометры, термоэлектрические датчики и термодинамические уравнения. Температуру можно измерять в разных единицах, таких как градус Цельсия, Кельвина или Фаренгейта.
Важно отметить, что температура играет ключевую роль не только в равновесии системы газа, но и во многих других физических и химических процессах. Знание и контроль температуры являются основой для выполнения точных измерений и регулирования промышленных процессов.
| Температура в системе газа | Свойства и изменения |
|---|---|
| Понижение температуры | Уменьшение средней кинетической энергии частиц, снижение давления и объема газа, возможность конденсации или замерзания газа |
| Повышение температуры | Увеличение средней кинетической энергии частиц, увеличение давления и объема газа, возможность испарения или испарения газа |
| Постоянная температура (равновесие) | Стабильная средняя кинетическая энергия частиц, одинаковая для всех частиц, равновесие в системе газа |
Регулирование температуры в системе газа может осуществляться через изменение условий окружающей среды, использование терморегуляторов, теплообменных систем и других специализированных устройств.
Изучение и понимание влияния температуры на равновесие системы газа позволяет эффективно контролировать и управлять физическими и химическими процессами, обеспечивая нужные условия для различных технических и научных задач.
🎬 Видео
Фазовые диаграммы. Тройная точка. Критическое состояние вещества. 10 класс.Скачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

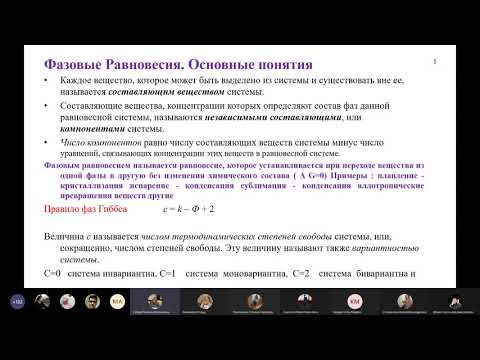
Фазовые равновесия | ФизхимияСкачать
Статика. Момент сил. Условия равновесия тел | Физика ЕГЭ, ЦТ, ЦЭ | Физика для школьниковСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

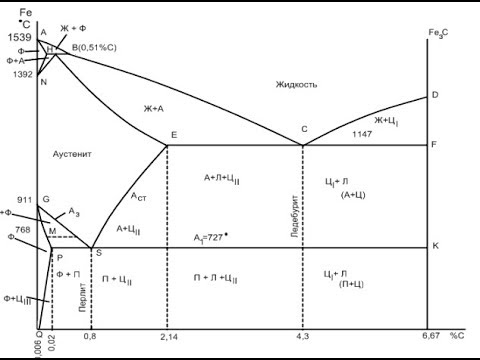
ДИАГРАММА СОСТОЯНИЯ ЖЕЛЕЗО-ЦЕМЕНТИТ, железо-углерод, Fe+Fe3CСкачать
Все формулы молекулярной физики, МКТ 10 класс, + преобразования и шпаргалкиСкачать

Физика 10 класс (Урок№19 - Температура. Энергия теплового движения молекул.)Скачать

4. Оскорбин А. А. | Как получить Газ? Изотермы Эндрюса. Идеальный газ. Моль. Уравнение состояния.Скачать

Основные положения молекулярно-кинетической теории газов и ее опытное обоснование. 10 класс.Скачать

Уравнение состояния идеального газа. Газовые законыСкачать

Сперматозоид-чемпион | наглядно показано оплодотворениеСкачать

Температура. Вывод уравнения состояния идеального газа на основе МКТСкачать

Температура и тепловое равновесие. Определение температуры | Физика 10 класс #30 | ИнфоурокСкачать

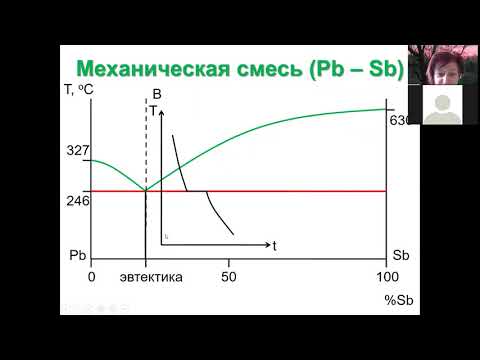
09 Фазовые диаграммы двухкомп сист 1 принципы и мех смесьСкачать