Третичная структура белков — это сложное и уникальное пространственное расположение аминокислот в молекуле белка. Она определяется последовательностью вторичных структур и направлением связей между ними. Формирование третичной структуры происходит под влиянием различных соединений и взаимодействий, которые играют ключевую роль в организации протеинов.
Одной из самых важных связей, определяющих третичную структуру белков, являются дисульфидные мосты. Эти связи образуются между атомами серы в разных остатках цистеина и стабилизируют пространственное положение белковой молекулы. Дисульфидные мосты обладают большой прочностью и могут выдерживать значительные механические нагрузки.
Кроме дисульфидных мостов, молекулы белков могут образовывать такие взаимодействия, как ван-дер-Ваальсовы силы, водородные связи и гидрофобные взаимодействия. Ван-дер-Ваальсовы силы возникают между атомами, которые временно образуют недлительные дипольные моменты. Водородные связи возникают между атомами водорода и атомами кислорода, азота или фтора. Гидрофобные взаимодействия связаны с образованием кластеров гидрофобных групп внутри белковой молекулы.
- Процесс формирования третичной структуры белков
- Роль вторичной структуры в формировании третичной структуры
- Повороты и спирали: ключевые элементы вторичной структуры
- Водородные связи: основа формирования вторичной структуры
- Виды связей, обеспечивающих третичную структуру белков
- Гидрофобные взаимодействия: силы, способствующие сворачиванию белка
- Роль электростатических взаимодействий в формировании третичной структуры белков
- Гидрофильные связи: участие в формировании третичной структуры белков
- 🔍 Видео
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Процесс формирования третичной структуры белков
Процесс формирования третичной структуры белков является сложным и динамичным. Он начинается после образования вторичной структуры, когда пространственное расположение элементов вторичной структуры начинает сворачиваться и стабилизироваться.
Основными факторами, определяющими третичную структуру белков, являются водородные связи, гидрофобные взаимодействия и электростатические взаимодействия. Водородные связи играют ключевую роль в формировании структуры белка, обеспечивая взаимодействие различных частей цепи и укрепляя их позицию в трехмерном пространстве.
Другим важным фактором являются гидрофобные взаимодействия, которые образуются между гидрофобными остатками аминокислот и способствуют сворачиванию белка в устойчивую трехмерную структуру. Электростатические взаимодействия также имеют важную роль в формировании третичной структуры, влияя на взаимодействие заряженных аминокислотных остатков.
Кроме того, третичная структура белков может поддерживаться гидрофильными связями, которые образуются между поларными остатками аминокислот. Эти связи способствуют укреплению трехмерной структуры и сохранению функциональности белка.
Используя эти различные виды взаимодействий, третичная структура белков формируется в результате сложных конформационных изменений и оказывает существенное влияние на его функции и свойства. Понимание механизмов образования третичной структуры белков имеет важное значение для разработки новых белковых лекарств и белковых материалов.
Видео:Третичная структура белкаСкачать
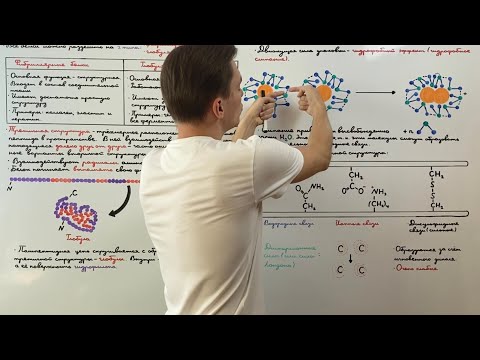
Роль вторичной структуры в формировании третичной структуры
Вторичная структура белков играет важную роль в процессе формирования третичной структуры. Она представляет собой локальные участки цепи аминокислот, которые приобретают определенную пространственную конформацию.
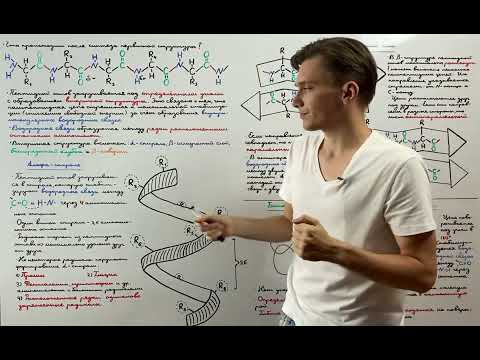
Ключевыми элементами вторичной структуры являются повороты и спирали. Повороты организуют цепь аминокислот в компактные структуры, а спирали, такие как альфа-спирали, образуют хеликальные участки цепи.
Основой формирования вторичной структуры являются водородные связи. Водородные связи образуются между атомом водорода, связанным с кислородом или азотом одной аминокислоты, и атомом кислорода или азота соседней аминокислоты. Эти связи способствуют укладке цепи в пространстве и определяют позицию боковых цепей аминокислот.
Вторичная структура белка является неотъемлемой частью его третичной структуры. Она обеспечивает предварительную пространственную организацию цепи, влияет на взаимодействие различных участков белка, а также определяет его функциональные свойства.
Повороты и спирали: ключевые элементы вторичной структуры
Повороты – это короткие участки цепи, в которых она меняет направление на 180 градусов. Они обеспечивают гибкость и изменчивость белковой структуры. Повороты позволяют белкам принимать различные конформации и адаптироваться к различным функциональным задачам.
Спирали или α-геликсы являются одним из наиболее распространенных элементов вторичной структуры. Они представляют собой спиральную форму, при которой цепь белка образует спиральную оболочку вокруг воображаемой оси. Спирали образуются благодаря водородным связям между аминокислотами, которые обеспечивают их устойчивость.
Повороты и спирали вторичной структуры белков важны для определения их пространственной конфигурации и функциональности. Они обеспечивают упаковку аминокислотных остатков в трехмерное пространство и создают определенную форму белка. Без поворотов и спиралей невозможно достичь оптимальной третичной структуры, которая обеспечивает правильное функционирование белка в клетке.
Водородные связи: основа формирования вторичной структуры
Водородные связи в белках играют важную роль в формировании вторичной структуры, такой как альфа-геликс и бета-складка. В альфа-геликсе водородные связи образуются между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты, создавая таким образом спиральную конформацию. В бета-складке водородные связи образуются между двумя соседними цепями аминокислот, приводя к их стабилизации в плоской конформации.
Особенностью водородных связей является их направленность. Возможность образования водородной связи зависит от расстояния и угла между атомами. Как только указанные параметры удовлетворяют определенным значениям, образуется устойчивая водородная связь.
Важно отметить, что водородные связи не только обеспечивают стабильность вторичной структуры белка, но и являются ее гибким элементом. В некоторых случаях, при изменении условий окружающей среды, водородные связи могут разорваться или образоваться, что в свою очередь позволяет белку принимать различные конформации и выполнять свои функции.
Таким образом, водородные связи играют существенную роль в формировании вторичной структуры белков, обеспечивая их устойчивость и гибкость. Это важное явление, которое необходимо учитывать при изучении третичной структуры белков и их функций в организме.
Видео:Первичная структура белкаСкачать

Виды связей, обеспечивающих третичную структуру белков
Одним из ключевых видов связей, обеспечивающих третичную структуру белков, являются дисульфидные мосты. Эти связи образуются между двумя цистеинами, которые содержат в своей структуре серу. Дисульфидные мосты могут быть сильными и не разрушимыми при изменении pH или температуры, что делает их основой для устойчивой третичной структуры.
Гидрофобные взаимодействия также играют важную роль в формировании третичной структуры белков. Эти взаимодействия возникают между гидрофобными участками аминокислотных цепочек, которые стремятся исключить контакт с водой. В результате гидрофобные группы сгруппировываются внутри белка, формируя гидрофобные ядра. Это способствует сворачиванию белка и созданию его третичной структуры.
Электростатические взаимодействия также играют роль в формировании третичной структуры белков. Они могут возникать между заряженными аминокислотными остатками, такими как аспартат и глютамат с одной стороны и аргинин, лизин или гистидин с другой стороны. Эти взаимодействия могут быть как притягивающими, так и отталкивающими, и подразумевают образование сети электростатических связей, обеспечивающих устойчивость третичной структуры.
Гидрофильные связи также принимают участие в формировании третичной структуры белков. Они могут возникать между полярными аминокислотными остатками, которые имеют электроотрицательные или электроположительные заряды. Эти взаимодействия могут быть слабыми и динамическими, позволяя белку принимать различные конформации и адаптироваться к изменениям окружающей среды.
Таким образом, различные виды связей, такие как дисульфидные мосты, гидрофобные взаимодействия, электростатические взаимодействия и гидрофильные связи, совместно обеспечивают третичную структуру белков. Это структурное организация белков позволяет им выполнять свои функции в клетках и организмах.
Гидрофобные взаимодействия: силы, способствующие сворачиванию белка
Гидрофобные взаимодействия являются одной из сил, способствующих сворачиванию белка в третичную структуру. Когда полипептидная цепь белка складывается, гидрофобные остатки сближаются друг с другом, формируя гидрофобные ямки или карманы. Это позволяет эффективно свернуть белок и минимизировать его контакт с водой. В результате, гидрофобные взаимодействия не только укрепляют структуру белка, но и обеспечивают его стабильность.
Гидрофобные взаимодействия имеют большое значение в биологических системах. Они участвуют в формировании центров активности белков, где происходят химические реакции, а также в молекулярном распознавании и связывании других молекул. Таким образом, гидрофобные взаимодействия не только определяют структуру белка, но и влияют на его функциональные свойства.
Таблица ниже представляет некоторые примеры аминокислотных остатков, обладающих гидрофобными свойствами:
| Аминокислота | Гидрофобный остаток |
|---|---|
| Лейцин | аланин |
| Изолейцин | валин |
| Фенилаланин | тирозин |
| Валин | аланин |
Как видно из таблицы, гидрофобные остатки могут быть разными, но их общая особенность состоит в том, что они являются неполярными и не растворяются в воде. Именно благодаря гидрофобным взаимодействиям белки принимают свою третичную структуру и обладают своими уникальными свойствами.
Роль электростатических взаимодействий в формировании третичной структуры белков
Электростатические взаимодействия играют важную роль в формировании третичной структуры белков. Эти взаимодействия происходят между заряженными аминоокислотными остатками, которые могут быть положительно или отрицательно заряжеными.
В результате электростатических взаимодействий формируются межмолекулярные связи между разными участками белка, что способствует его сворачиванию и созданию стабильной третичной структуры. Эти взаимодействия могут быть привлекательными или отталкивающими.
Привлекательные электростатические взаимодействия образуются между положительно и отрицательно заряженными остатками, такими как аргинин и глутамат. Они способствуют привлечению и удержанию этих остатков рядом друг с другом, что способствует укладке белка и формированию его третичной структуры.
Отталкивающие электростатические взаимодействия возникают между зарядами одинакового знака, например, между двумя положительно или двумя отрицательно заряженными остатками. Эти взаимодействия могут препятствовать сворачиванию белка, так как они создают отталкивающую силу.
Важно отметить, что электростатические взаимодействия в третичной структуре белков могут быть сильно зависимы от окружающей среды. Изменение pH, температуры или концентрации ионов может значительно влиять на эти взаимодействия и, следовательно, на стабильность и функциональность белка.
Таким образом, электростатические взаимодействия являются важным фактором, определяющим сворачивание и формирование третичной структуры белков. Изучение этих взаимодействий позволяет лучше понять механизмы, лежащие в основе белковой структуры и их функции.
Гидрофильные связи: участие в формировании третичной структуры белков
Гидрофильные связи играют важную роль в процессе формирования третичной структуры белков. Эти связи возникают между гидрофильными аминокислотами, которые имеют аффинность к воде.
Гидрофильные аминокислоты, такие как лизин, аргинин и глютамин, обладают поларными или заряженными группами, которые способны взаимодействовать с молекулами воды. Когда белок сворачивается и формирует третичную структуру, гидрофильные аминокислоты могут вступать в гидрофильные связи с водой или другими поларными группами белка.
Гидрофильные связи играют важную роль в стабилизации третичной структуры белков. Они помогают формированию петель и спиралей в структуре белка, улучшая его компактность и устойчивость. Кроме того, гидрофильные связи также способствуют взаимодействию белка с растворителем и другими молекулами, что может быть важно для его функционирования.
Образование гидрофильных связей зависит от окружающей среды и условий, в которых находится белок. Вода играет ключевую роль в образовании этих связей, так как водные молекулы могут образовывать водородные связи с гидрофильными аминокислотами.
| Примеры гидрофильных аминокислот | Химические свойства |
|---|---|
| Лизин (Lys) | Имеет положительный заряд |
| Аргинин (Arg) | Имеет положительный заряд |
| Глютамин (Gln) | Имеет поларную группу |
Гидрофильные связи представляют собой важную составляющую третичной структуры белков. Они работают вместе с другими типами связей, такими как водородные связи и гидрофобные взаимодействия, чтобы обеспечить стабильность и функциональность белка.
🔍 Видео
Биохимия | Строение белков часть 1Скачать

Вторичная структура белкаСкачать
Строение и уровни структурной организации белков. 10 класс.Скачать

Третичная структура белка (видео 11) | Макромолекулы | БиологияСкачать

Структура белковСкачать

Структуры белкаСкачать

Как устроена первичная структура белка? Душкин объяснитСкачать

Структурная организация белков / БИОХИМИЯ белков, биохимия аминокислот, белки теплового шокаСкачать

Биохимия. Лекция 2. Белки. Уровни организации белков. Функции белков.Скачать

Что такое третичная структура биополимеров? Душкин объяснитСкачать

Биохимия. Конформация белков. Фолдинг белков.Скачать

Строение и функции белков.Скачать

Структура белковой молекулы. БиохимияСкачать

Цитология. Лекция 21. Третичная и четвертичная структуры белкаСкачать

Структура ДНКСкачать

PROСТО О СЛОЖНОМ Олигомерные белки, биохимия №3Скачать

Четвертичная структура белкаСкачать

