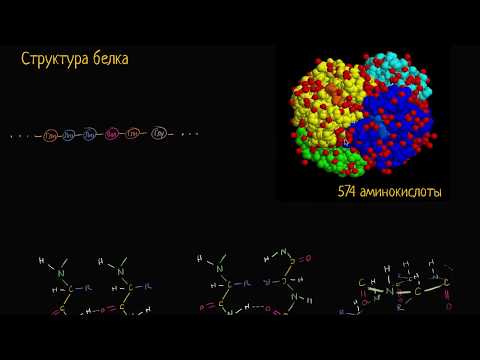
Секундарная структура белков — это важное понятие из области биохимии и молекулярной биологии. Эта структура отображает специфичные связи и взаимодействия между аминокислотными остатками внутри белка, определяя его форму и функцию.
Главными видами связей, характерными для вторичной структуры белка, являются водородные связи и пептидные связи. Водородные связи образуются между атомами водорода одной аминокислоты и атомами кислорода или азота других аминокислот. Они играют важную роль в формировании пространственных структур белка и могут образовываться как внутри одной последовательности аминокислот, так и между разными цепями.
Пептидные связи представляют собой основу вторичной структуры белка. Они образуются между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты. Пептидные связи образуют цепочки, состоящие из аминокислотных остатков, образуя спиральную структуру — альфа-спираль или бета-спираль.
Понимание связей, присутствующих в вторичной структуре белка, позволяет ученым лучше понять и предсказать его свойства и функции. Это особенно важно в разработке лекарств и решении множества медицинских проблем. Узнайте больше подробностей о вторичной структуре белка и ее связях, чтобы расширить свои знания о мире биохимии и молекулярной биологии.
Видео:Биохимия. Лекция 2. Белки. Уровни организации белков. Функции белков.Скачать

Вторичная структура белка: ключевые характеристики
Ключевые характеристики вторичной структуры белка включают:
Полипептидную спираль. Одной из основных форм вторичной структуры является альфа-спираль. В этой конформации полипептидная цепь сворачивается в виде спирали. Важно отметить, что аминокислоты в спирали связаны внутренними водородными связями, обеспечивая стабильность структуры.
Бета-складка. Другой распространенной формой вторичной структуры является бета-складка. В этой конформации параллельные или антипараллельные фрагменты полипептидной цепи сворачиваются в виде стержня и соединяются водородными связями. Бета-складка обладает особыми механическими свойствами и часто встречается в поверхностных участках белков.
Антителеватые связи. Вторичная структура белка может образовывать сложные трехмерные конформации, называемые антителеватыми связями. В этих конформациях главные цепи аминокислот выстраиваются в спираль, создавая петли и неправильные витки. Антителеватые связи способствуют увеличению разнообразия форм и функций белков.
Вторичная структура белка важна для его функционирования, так как определяет его свойства и взаимодействие с другими молекулами. Понимание ключевых характеристик этой структуры позволяет лучше понять механизмы работы белков и их роль в клеточных процессах.
Видео:Вторичная структура белкаСкачать
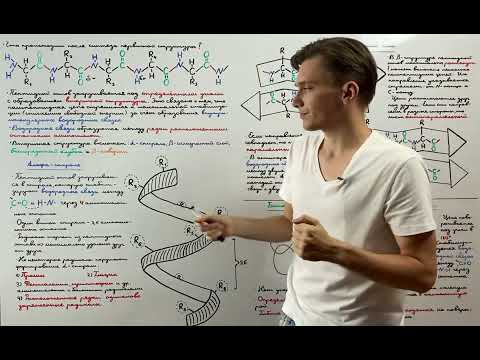
Полипептидная спираль
Полипептидная спираль, или альфа-спираль, образуется благодаря взаимодействию между водородными связями аминокислотных остатков, находящихся на близком расстоянии друг от друга в последовательности белка. В результате таких взаимодействий спиральная структура формируется вокруг воображаемой оси, проходящей по центру спирали.
Аминокислотные остатки в полипептидной спирали образуют пространственные укладки, которые связаны друг с другом внутренними водородными связями. Это позволяет белку приобрести определенную пространственную конфигурацию, которая важна для его функционирования.
Полипептидная спираль может быть представлена как праворучная или леворучная, в зависимости от вращения вокруг оси. Она состоит из поворотов, в каждом из которых аминокислотный остаток смещается на 3.6 ангстрема вдоль оси спирали. Каждый поворот в полипептидной спирали состоит из 13 аминокислотных остатков.
Однако, важно отметить, что не все белки могут образовывать полипептидные спирали. Некоторые белки могут иметь другие формы вторичной структуры, такие как бета-складка или случайная каталка.
Таким образом, полипептидная спираль является одной из основных форм вторичной структуры белка, где аминокислотные остатки организуются в спиральную структуру благодаря водородным связям. Эта структура важна для функционирования белка и определяет его структурные и функциональные свойства.
Расположение аминокислот
Аминокислоты встречаются в белках в виде остатков, которые связаны друг с другом пептидными связями. Каждая аминокислота имеет аминогруппу (-NH2) и карбоксильную группу (-COOH), которые присоединены к общему атому углерода (альфа-атому). Таким образом, аминокислоты образуют цепочку, которая является основой для формирования вторичной структуры.
Вторичная структура белка определяется пространственными соединениями между аминокислотами. Например, аминокислоты могут быть связаны амидными связями (-CONH-) или карбонильными связями (-CO-). Эти связи образуют жесткие плоскости, которые определяют конформацию белковой цепи.
Расположение аминокислот может быть локальным или глобальным. Локальное расположение описывает способ, в котором близлежащие аминокислоты связаны друг с другом. Примерами локальных структур являются альфа-спираль и бета-складка.
Глобальное расположение описывает общую конформацию всей белковой цепи. Оно может включать в себя повороты и сворачивания, которые образуются в результате взаимодействия между дальними аминокислотами. Глобальное расположение определяет структуру белка в целом и его функциональные свойства.
Таким образом, расположение аминокислот играет важную роль в формировании вторичной структуры белка. Оно определяет пространственную ориентацию аминокислот и способствует образованию определенных конформаций, которые влияют на функциональность и стабильность белка.
Водородные связи во вторичной структуре белка
Водородные связи образуются между группами аминокислотных остатков и играют важную роль в стабилизации вторичной структуры. Они возникают между атомами водорода, которые связаны с электроотрицательными атомами кислорода и азота, и электронными облаками этих атомов.
Главные типы водородных связей во вторичной структуре белка – это связи между аминокислотными остатками в противоположных пролиновых остовах, образующие антипараллельные β-листы, и связи между аминокислотными остатками в одном пролиновом остове, образующие параллельные β-листы.
Водородные связи обладают значительной прочностью и благодаря им вторичная структура белка приобретает стабильность и сохраняет свою конформацию. Они также играют роль в формировании межмолекулярных водородных связей, что имеет важное значение для образования третичной и кватернарной структуры белков.
Таким образом, водородные связи являются одним из ключевых элементов вторичной структуры белка, обеспечивая его стабильность и функциональность.
Альфа-спираль
Альфа-спираль образуется, когда полипептидная цепь начинает поворачиваться вокруг воображаемой оси, образуя спиральный виток. В каждом витке аминокислоты образуют водородные связи с аминокислотами, находящимися на трех аминокислотных остатках выше и ниже витка.
Ключевым свойством альфа-спирали является ее устойчивость и прочность. Водородные связи, удерживающие аминокислоты в спиральной структуре, играют важную роль в этом процессе. Они образуются между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты.
Альфа-спираль может быть разной длины, и количество аминокислот в каждом витке может варьироваться. Эти различия в структуре альфа-спирали могут влиять на свойства и функции белка. Некоторые белки содержат несколько альфа-спиралей, которые могут взаимодействовать друг с другом и образовывать сложные трехмерные структуры.
Альфа-спираль играет важную роль в стабилизации вторичной структуры белка и может быть найдена во многих белках, выполняющих различные функции. Понимание альфа-спирали и ее свойств помогает ученым лучше понять структуру и функцию белков и может быть полезным в разработке новых лекарственных препаратов и биотехнологических продуктов.
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Бета-складка
| Характеристики | Описание |
| Параллельные и антипараллельные фрагменты | В бета-складке могут присутствовать как параллельные, так и антипараллельные фрагменты. В параллельных фрагментах нити протягиваются в одном направлении, а в антипараллельных — в противоположных. |
| Водородные связи | Водородные связи играют важную роль в стабилизации бета-складки. Они образуются между атомами кислорода и водорода в растворителе. Водородные связи образуются между соседними нитями белка, что способствует их укреплению. |
Бета-складка может принимать различные пространственные конформации, такие как плоский лист, кольцо или виток. Эта структура имеет важное значение для функционирования большинства белков и является одним из основных элементов их третичной структуры.
Понимание бета-складки позволяет углубить наши знания о вторичной структуре белков и расширить возможности в области дизайна новых белков и разработки лекарственных препаратов на их основе.
Параллельные и антипараллельные фрагменты
Параллельные фрагменты представляют собой участки белка, где полипептидные цепи расположены параллельно друг другу. Это значит, что N-концы (концы с аминогруппами) и C-концы (концы с карбоксильными группами) аминокислотных остатков смотрят в одном направлении. Параллельные фрагменты образуются благодаря образованию водородных связей между аминокислотами, что укрепляет структуру белка.
Антипараллельные фрагменты, в свою очередь, представляют собой участки белка, где полипептидные цепи расположены в противоположных направлениях. N-концы одной цепи смотрят в сторону C-концов другой цепи и наоборот. Антипараллельные фрагменты также образуются при помощи водородных связей между аминокислотами, обеспечивая стабильность и прочность вторичной структуры белка.
Параллельные и антипараллельные фрагменты являются важными элементами вторичной структуры белка, которые влияют на его функционирование и взаимодействие с другими молекулами. Изучение и понимание этих характеристик позволяет установить связь между структурой и функцией белка, что имеет большое значение в биохимических и медицинских исследованиях.
Антителеватые связи
В антителеватых связях аминокислоты вступают во взаимодействие через свои боковые цепи. Боковые цепи различных аминокислот образуют силы притяжения и отталкивания, которые диктуют пространственную ориентацию и конформацию вторичной структуры белка.
Антителеватые связи также играют важную роль в формировании третичной и кватернарной структуры белка. Они обеспечивают стабильность и устойчивость белковой цепи, позволяют белку принимать определенные конформации и фиксируют его трехмерную структуру.
Антителеватые связи являются необходимыми для правильного функционирования белков и выполняют различные роли в организме. Они могут контролировать активность белка, участвовать в детекции и связывании сигналов, обеспечивать взаимодействие белков с другими молекулами и субклеточными структурами.
В целом, антителеватые связи позволяют белкам обладать уникальными структурами и функциями, которые определяют их роль в клеточных процессах и заболеваниях. Понимание антителеватых связей и вторичной структуры белка является ключевым шагом в исследовании протеинов и разработке новых лекарственных препаратов.
📽️ Видео
Строение и уровни структурной организации белков. 10 класс.Скачать

Структура белковСкачать

Первичная структура белкаСкачать

Биосинтез белка за 3 минуты (даже меньше)Скачать

Аминокислоты, белки. Строение белков. Уровни организации белковой молекулы. Видеоурок по биологии 10Скачать

Как устроена первичная структура белка? Душкин объяснитСкачать

2. Первичная и вторичная структуры белкаСкачать

Структуры белкаСкачать

Биохимия. Конформация белков. Фолдинг белков.Скачать

Третичная структура белкаСкачать
ЛЕКЦИЯ 4. АМИНОКИСЛОТЫ, БЕЛКИСкачать

Строение и функции белков.Скачать

Не бЕлки, а белкИ. Все для ЕГЭ | Биология ЕГЭ 2023 | УмскулСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Третичная структура белка (видео 11) | Макромолекулы | БиологияСкачать

СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ. ОБЩАЯ БИОХИМИЯ. ЛЕКЦИЯ 1.Скачать

Обзор структуры белка (видео 10) | Макромолекулы | БиологияСкачать