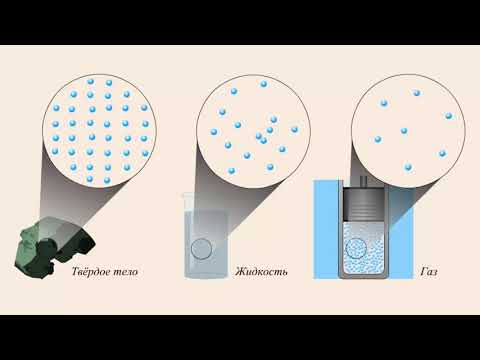
Парообразное или газообразное состояние вещества — это одно из четырех основных физических состояний вещества, помимо твердого, жидкого и плазменного состояний. Газы характеризуются низкой плотностью, высокой подвижностью и способностью занимать объем любой формы и размеров.
Однако не все газы могут считаться паром. Состояние пара вещества характеризуется тем, что оно находится при температуре, близкой к его температуре кипения. То есть, если жидкость при нагревании переходит в газообразное состояние, но еще остается рядом с ней и не разбредается по всему объему, этот газ называют паром.
При переходе вещества из жидкого состояния в газообразное происходит испарение. Парообразные частицы, постепенно освобождаясь от молекул жидкости, заполняют свободное пространство и создают парную фазу. Тем самым пар состоит из частиц одного и того же вещества.
Примерами парообразного состояния вещества являются пар от кипящей воды или парообразные вещества в воздухе, такие как влага, спирты и другие летучие жидкости. Они превращаются в пар, но остаются вблизи исходной летучей жидкости.
Видео:Плазма - ЧЕТВЁРТОЕ состояние веществаСкачать

Что такое пар газ?
Пар газ может быть образован при повышении температуры или снижении давления вещества. При этом, молекулы или атомы становятся энергичнее и начинают двигаться с большей скоростью. Это приводит к их отделению друг от друга и образованию пара газа.
Примером пара газа является пар воды. Когда вода нагревается, ее молекулы получают больше энергии и начинают выходить из жидкого состояния в форме пара газа. Пар воды можно увидеть, например, при кипении воды или после того, как одежда высохла после стирки на солнце.
Другим примером пара газа является парфюм или ароматное масло, которые испаряются при комнатной температуре. В итоге, мы ощущаем запах этих веществ в воздухе.
Видео:Три состояния веществаСкачать

Определение пара газа
Пар газ обладает свойствами типичными для газов, такими как высокая подвижность, слабая вязкость и компрессибильность. Он может заполнять пространство, в котором находится, равномерно распределенной, что обуславливает его рассеивание в атмосфере.
Примером пара газа может быть водяной пар, который образуется при нагревании воды до температуры кипения (100°C на уровне моря). При этой температуре молекулы воды получают достаточно энергии для перехода в газообразное состояние и образуют пар. Однако, при температуре ниже 100°C, вода находится в жидком состоянии или может конденсироваться в виде капель.
Существует множество других веществ, которые могут находиться в состоянии пара газа, таких как аммиак, этилен, пропан и многое другое. Пар газ обладает различными применениями в повседневной жизни, включая использование в качестве топлива, приготовления пищи, отопления и охлаждения.
Какое состояние вещества называется паром газом
Примером пара газа может служить водяной пар, который образуется при нагревании воды до определенной температуры. Когда вода кипит, она превращается в пар, который можно наблюдать в виде облаков или тумана. Водяной пар также может быть невидимым, особенно если его концентрация в воздухе невысока.
Пары газов могут образовываться и из различных химических веществ. Например, при нагревании эфира, он превращается в пар, который можно вдыхать. Также сернистые газы могут образовываться при сгорании топлива, что приводит к образованию дыма и тяжелого запаха. Взаимодействие жидких или твердых веществ с окружающей средой также может приводить к образованию пара газа.
Видео:Агрегатные состояния вещества. 7 класс.Скачать

Примеры пара газа
1. Вода. При нагревании вода превращается в пар газ. Это происходит, когда температура достигает 100 градусов Цельсия. Пар газ воды используется для создания паровых двигателей, производства электроэнергии, а также для нагрева и охлаждения.
2. Кислород. Кислород, содержащийся в атмосфере, является газообразным состоянием этого элемента. Он важен для поддержания жизни на Земле и используется в медицине, в промышленности и в других сферах деятельности человека.
3. Углекислый газ. Углекислый газ также является паром газа и образуется при сгорании углеводородов или в результате дыхания живых организмов. Он играет важную роль в процессе фотосинтеза растений и используется в различных отраслях, включая пищевую промышленность и нефтяную промышленность.
4. Воздух. Воздух состоит из смеси газов, таких как кислород, азот, углекислый газ и другие. Главными компонентами воздуха являются азот (примерно 78%) и кислород (примерно 21%). Воздух используется для дыхания, сжигания топлива, охлаждения и других целей.
5. Аммиак. Аммиак – это еще один пример пара газа. Он имеет резкий запах и применяется в промышленности для производства удобрений, чистки и других процессов.
Это лишь некоторые примеры пара газа, который играет важную роль в природе и обществе. Знание свойств и применений пара газа позволяет нам более полно понять и использовать данный физический состав в повседневной жизни.
Примеры веществ, пребывающих в состоянии пара газа
Существует множество веществ, которые могут находиться в состоянии пара газа. Рассмотрим некоторые из них:
- Кислород: Кислород является одним из самых распространенных газообразных веществ на Земле. Он используется для дыхания живых организмов и необходим для поддержания жизни.
- Азот: Азот также является газообразным веществом, которое составляет большую часть атмосферы Земли. Он используется в промышленности для создания инертной среды и в сельском хозяйстве для улучшения урожайности почвы.
- Водород: Водород — это легкий и высокоэнергичный газ, который используется в различных отраслях промышленности, включая производство аммиака и метанола.
- Углекислый газ: Углекислый газ — это продукт сгорания угля и нефти, а также выдыхаемый газ живыми организмами. Он является одним из главных газов, способствующих парниковому эффекту.
- Неон: Неон — инертный газ, который обладает ярким сиянием при подаче электрического тока. Он используется в рекламе и освещении.
- Метан: Метан — это газ, который образуется при разложении органического материала. Он используется в качестве топлива и в производстве пластика.
Это лишь некоторые примеры веществ, которые могут находиться в состоянии пара газа. Каждое из этих веществ имеет свои уникальные свойства и применения в различных областях.
Как пар газ используется в повседневной жизни
Пар газ также широко применяется в промышленности для процессов нагрева и охлаждения. Он используется в системах отопления и кондиционирования воздуха, позволяя создавать комфортные условия в помещениях. Кроме того, пар газ используется в промышленных процессах, таких как сушка, глажение, стрижка и т.д.
Также пар газ находит применение в медицине, а именно в стерилизации и дезинфекции. В больницах и клиниках пар газ используется для обеззараживания инструментов и поверхностей, чтобы предотвратить распространение инфекций. Он также применяется для создания паровых ингаляций при лечении респираторных заболеваний.
Необходимо отметить и использование пара газа в бытовых целях. Паровые утюги и парогенераторы широко распространены в современных домашних хозяйствах. Они позволяют более эффективно выпрямлять складки на одежде и избавляться от неприятных запахов.
Наконец, пар газ используется в автомобильной промышленности в процессе охлаждения двигателей. Он помогает регулировать температуру и предотвращает перегрев механизма, что позволяет автомобилям работать более эффективно и продлевает их срок службы.
Таким образом, пар газ является важным элементом нашей повседневной жизни и находит применение в различных сферах, способствуя нашему комфорту и обеспечению удобств.
Видео:Физика 8 класс (Урок№5 - Агрегатные состояния вещества.)Скачать

Свойства пара газа
- Дата измениения: 21 июля 2021 г.
- Автор: Ваше имя
- Диффузия. Молекулы пара газа способны перемешиваться с другими молекулами газов. Этот процесс называется диффузией. Благодаря диффузии пар газа равномерно распределяется в пространстве.
- Экспансия. Пар газа может расширяться и занимать больше объема при увеличении температуры. Это связано с тем, что при нагревании молекулы газа получают энергию, что позволяет им двигаться быстрее и занимать больше места.
- Компрессия. Наоборот, пар газа может сжиматься и занимать меньший объем при увеличении давления. При уменьшении объема между молекулами возникают силы притяжения и сжатие по газовому закону.
- Распределение давления. Пар газа возможно создавать давление на поверхности тела. Молекулы, сталкиваясь с поверхностью, оказывают на нее давление.
- Низкая плотность. Пар газа обладает низкой плотностью в сравнении, например, с жидкостью. Это связано с большим расстоянием между молекулами и их свободным перемещением.
Эти свойства пара газа определяют его поведение и применимость в различных областях, например, в промышленности (воздух, пары отработавшего пара, газы сжиженного природного газа) и в нашей повседневной жизни (воздух, водород, кислород и другие газы, используемые в быту).
Температура изменения состояний вещества
У разных веществ есть разные температуры плавления и кипения, при которых происходит изменение их состояния. Например, для воды температура плавления составляет 0 градусов Цельсия, а температура кипения — 100 градусов Цельсия.
Когда вещество нагревается, его молекулы начинают двигаться быстрее, что приводит к изменению связей между ними. При достижении определенной температуры связи между молекулами ослабевают и вещество переходит в другое состояние. Например, при нагревании льда его молекулы начинают двигаться быстрее, что приводит к разрыву связей между ними и образованию жидкой воды.
Температура изменения состояний вещества может быть различной для разных веществ. Кроме того, она может зависеть от давления, при котором происходит фазовый переход. Например, точка кипения воды находится на уровне моря при давлении 1 атмосферы, но при повышении или понижении давления эта температура может измениться.
Знание температуры изменения состояний вещества является важным для многих областей науки и техники. Она позволяет предсказать и контролировать фазовые переходы вещества и использовать его свойства в практических целях. Например, знание точки кипения позволяет оптимизировать процессы перегонки и конденсации в промышленности, а знание точки твердения — управлять процессами кристаллизации и замораживания.
📹 Видео
Агрегатные состояния вещества | Физика 7 класс #7 | ИнфоурокСкачать

Физика 7 класс (Урок№6 - Агрегатные состояния вещества. Обобщение темы «Строение вещества»)Скачать

Плазма — четвёртое агрегатное состояние веществаСкачать

Агрегатные состояния. Плавление и отвердевание | Физика 8 класс #4 | ИнфоурокСкачать

Плазма – четвертое состояние вещества.Скачать

Состояния веществаСкачать

Различные агрегатные состоянияСкачать
Как понять что вещество выпадает в осадок или образуется газСкачать

Фазовые диаграммы. Тройная точка. Критическое состояние вещества. 10 класс.Скачать

3. Агрегатные состояния веществаСкачать

Предмет химии. Вещества и их свойства. 7 класс.Скачать

Химия, 9-й класс, Газообразное состояние веществаСкачать

Агрегатные состояния вещества. Расположение молекул воды в разных агрегатных состояниях.Скачать
Естествознание. 6 класс. Строение и свойства веществ. Молекулы и атомы. Простые и сложные веществаСкачать

7 класс. Физика. Агрегатные состояния веществаСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

