Кислоты — это химические соединения, которые имеют способность отдавать протоны (водородные ионы) в растворе. Однако, не все кислоты способны полностью диссоциировать и образовывать ионы при растворении в воде. Такие кислоты называются слабыми электролитами и обладают особыми характеристиками.
Главное отличие слабых кислот от сильных заключается в степени их диссоциации. В отличие от сильных кислот, которые диссоциируются полностью, слабые кислоты диссоциируются только частично. Это означает, что в растворе находится как недиссоциированная форма кислоты, так и диссоциированная форма в виде ионов.
Для слабых кислот характерна невысокая степень диссоциации и поэтому они обладают меньшей кислотностью по сравнению с сильными кислотами. Например, уксусная кислота (CH3COOH) и угольная кислота (H2CO3) являются примерами слабых кислот.
- Кислоты: слабые электролиты или нет?
- Что такое слабые электролиты
- Определение электролитов
- Различные типы электролитов
- Кислоты: слабые или сильные электролиты?
- Определение кислоты Кислоты могут быть двух типов: сильные и слабые. Сильные кислоты в воде полностью диссоциируются на ионы водорода и анионы кислоты. Примеры сильных кислот включают серную, соляную и хлороводородную кислоты. Слабые кислоты, с другой стороны, не полностью диссоциируются в воде и существуют в виде равновесной смеси ионизированных и неионизированных молекул. Примеры слабых кислот включают уксусную, угольную и молочную кислоты. Сильные и слабые кислоты отличаются величиной константы ионизации (Kа). У сильных кислот Kа очень большая, поэтому они полностью ионизируются в воде. В случае слабых кислот Kа небольшая и они не полностью диссоциируются. Знание о том, какие кислоты являются слабыми электролитами, очень полезно для понимания химических реакций, многих биологических процессов и соединений, которые мы встречаем в повседневной жизни. Сильные и слабые кислоты Кислоты могут быть разделены на две основные категории: сильные и слабые электролиты. Сильные кислоты полностью диссоциируют в воде, образуя большое количество ионов водорода (H+). Примерами сильных кислот являются соляная кислота (HCI), серная кислота (H2SO4) и азотная кислота (HNO3). Когда они растворяются в воде, они полностью распадаются на ионы H+ и соответствующие анионы. Слабые кислоты, напротив, не диссоциируют полностью в воде и образуют меньшее количество ионов H+. Они могут оставаться в виде молекул в водном растворе. Примерами слабых кислот являются уксусная кислота (CH3COOH), молочная кислота (C3H6O3) и фосфорная кислота (H3PO4). Когда эти кислоты растворяются в воде, они диссоциируют только частично, оставаясь в виде как ионов H+, так и недиссоциированных молекул. Слабые кислоты имеют более слабое влияние на pH растворов, так как они распадаются в меньшем количестве ионов H+. В то же время, сильные кислоты, такие как соляная кислота, могут служить сильными окислителями и обладают более низким pH. Понимание различий между сильными и слабыми кислотами важно для химических реакций и установления равновесия в системе. В зависимости от конкретной задачи и контекста, какая-то кислота может быть сильным или слабым электролитом, и определение ее свойств является ключевым фактором в проведении многих химических экспериментов и процессов.
- Кислоты могут быть двух типов: сильные и слабые. Сильные кислоты в воде полностью диссоциируются на ионы водорода и анионы кислоты. Примеры сильных кислот включают серную, соляную и хлороводородную кислоты. Слабые кислоты, с другой стороны, не полностью диссоциируются в воде и существуют в виде равновесной смеси ионизированных и неионизированных молекул. Примеры слабых кислот включают уксусную, угольную и молочную кислоты. Сильные и слабые кислоты отличаются величиной константы ионизации (Kа). У сильных кислот Kа очень большая, поэтому они полностью ионизируются в воде. В случае слабых кислот Kа небольшая и они не полностью диссоциируются. Знание о том, какие кислоты являются слабыми электролитами, очень полезно для понимания химических реакций, многих биологических процессов и соединений, которые мы встречаем в повседневной жизни. Сильные и слабые кислоты Кислоты могут быть разделены на две основные категории: сильные и слабые электролиты. Сильные кислоты полностью диссоциируют в воде, образуя большое количество ионов водорода (H+). Примерами сильных кислот являются соляная кислота (HCI), серная кислота (H2SO4) и азотная кислота (HNO3). Когда они растворяются в воде, они полностью распадаются на ионы H+ и соответствующие анионы. Слабые кислоты, напротив, не диссоциируют полностью в воде и образуют меньшее количество ионов H+. Они могут оставаться в виде молекул в водном растворе. Примерами слабых кислот являются уксусная кислота (CH3COOH), молочная кислота (C3H6O3) и фосфорная кислота (H3PO4). Когда эти кислоты растворяются в воде, они диссоциируют только частично, оставаясь в виде как ионов H+, так и недиссоциированных молекул. Слабые кислоты имеют более слабое влияние на pH растворов, так как они распадаются в меньшем количестве ионов H+. В то же время, сильные кислоты, такие как соляная кислота, могут служить сильными окислителями и обладают более низким pH. Понимание различий между сильными и слабыми кислотами важно для химических реакций и установления равновесия в системе. В зависимости от конкретной задачи и контекста, какая-то кислота может быть сильным или слабым электролитом, и определение ее свойств является ключевым фактором в проведении многих химических экспериментов и процессов.
- Сильные и слабые кислоты
- 🔥 Видео
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Кислоты: слабые электролиты или нет?
В химии кислоты классифицируются на сильные и слабые в зависимости от их способности диссоциировать в водном растворе.
Сильные кислоты являются полностью диссоциированными электролитами в воде, что означает, что они распадаются на ионы в большом количестве и обладают значительной проводимостью. Примерами сильных кислот являются соляная кислота (HCl), серная кислота (H2SO4) и азотная кислота (HNO3).
С другой стороны, слабые кислоты диссоциируются лишь частично в воде и обладают низкой проводимостью. Они образуют меньшее количество ионов в растворе. Например, уксусная кислота (CH3COOH) и угольная кислота (H2CO3) являются примерами слабых кислот.
Определить, является ли кислота сильным или слабым электролитом, можно, рассматривая ее способность образовывать ионы при диссоциации. Если кислота полностью диссоциирует, она считается сильным электролитом. Если она диссоциирует только частично, то это слабый электролит.
Важно отметить, что классификация кислот на сильные или слабые электролиты зависит от их концентрации в растворе и условий. Некоторые кислоты могут проявлять свойства сильных электролитов при высоких концентрациях или в определенных условиях.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Что такое слабые электролиты
У слабых электролитов есть характерная особенность — их ионизация зависит от концентрации раствора и степени диссоциации. С увеличением концентрации раствора или с понижением температуры их ионизация может возрастать. Также слабые электролиты обладают низкой электропроводностью по сравнению со сильными электролитами.
Примерами слабых электролитов являются: уксусная кислота (CH3COOH), аммиак (NH3), сероводород (H2S), угольная кислота (H2CO3) и многие другие. Эти вещества обычно не обладают сильными кислотными или щелочными свойствами, так как только небольшая их часть ионизируется при растворении, остальная часть остается в молекулярной форме.
Знание о том, какие вещества являются слабыми электролитами, имеет большое значение в химии и аналитической химии, поскольку позволяет оценить степень их диссоциации и провести расчеты при проведении различных химических реакций и экспериментов.
Определение электролитов
Различают два типа электролитов — сильные и слабые. Сильные электролиты диссоциируют полностью, образуя большое количество ионов. Они обладают высокой проводимостью электрического тока и являются эффективными проводниками электричества.
Слабые электролиты, в свою очередь, диссоциируются неполностью, образуя малое количество ионов. Их проводимость электрического тока намного ниже, поскольку только небольшая часть молекул претерпевает диссоциацию.
Для кислот процесс диссоциации выглядит следующим образом: молекула кислоты отделяет протон (H+) и образует соответствующий отрицательно заряженный ион (анцион). Слабые кислоты диссоциируют неполностью, при этом их молекулы сохраняются в растворе, а процесс диссоциации протекает в меньшей степени.
Важно отметить, что проводимость электрического тока зависит от концентрации ионов в растворе. Чем больше ионов образуется при диссоциации, тем выше будет проводимость электрического тока.
Знание о том, какие кислоты являются слабыми электролитами, позволяет более точно определить их свойства и использование в различных химических процессах и реакциях.
Различные типы электролитов
Сильные электролиты — это вещества, полностью диссоциирующие в воде и образующие ионы. Положительные ионы называются катионами, а отрицательные — анионами. Примерами сильных электролитов являются HCl (соляная кислота), HNO3 (азотная кислота) и NaOH (натриевая гидроксид).
Слабые электролиты — это вещества, которые диссоциируют в растворе лишь частично. То есть только некоторая доля молекул слабого электролита разлагается на ионы. Примерами слабых электролитов могут быть уксусная кислота (CH3COOH), молочная кислота (C3H6O3) и H2CO3 (кислота угольная).
Для образования ионов слабые электролиты требуют некоторого энергетического вклада, поэтому их степень ионизации невелика. В растворе слабые электролиты присутствуют как ионы, так и недиссоциированные молекулы.
Важно отметить, что распределение электролитов на сильные и слабые зависит от условий их растворения. Некоторые вещества могут быть сильными электролитами в одних условиях и слабыми в других.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Кислоты: слабые или сильные электролиты?
Кислоты могут быть как слабыми, так и сильными электролитами, в зависимости от их способности диссоциировать в растворе.
Сильные электролиты — это кислоты, которые полностью диссоциируют в растворе, образуя ионные растворы. Такие кислоты обычно образуются из ионных соединений и обладают высокой степенью ионизации. Примерами сильных электролитов являются соляная кислота (HCl), серная кислота (H2SO4) и азотная кислота (HNO3).
Слабые электролиты — это кислоты, которые только частично диссоциируют в растворе. Это означает, что только небольшая часть молекул кислоты распадается на ионы. Следовательно, раствор слабого электролита будет содержать как недиссоциированные молекулы, так и ионы. Примером слабого электролита является уксусная кислота (CH3COOH).
Определение слабых и сильных электролитов основано на их способности проводить электрический ток в растворе. Сильные электролиты, полностью диссоциируя, образуют большое количество ионов и хорошо проводят электрический ток. С другой стороны, слабые электролиты, диссоциируя только частично, образуют меньше ионов и плохо проводят электрический ток.
Важно отметить, что способность кислоты быть сильным или слабым электролитом не зависит от ее кислотности или основности. Например, сильные электролиты могут быть как кислотными, так и щелочными, а также нейтральными соединениями. Главное, что их диссоциация в растворе происходит практически полностью.
Понимание разницы между слабыми и сильными электролитами помогает в изучении реакций, кислотно-основного баланса и других аспектов химии.
Определение кислоты
Кислоты могут быть двух типов: сильные и слабые. Сильные кислоты в воде полностью диссоциируются на ионы водорода и анионы кислоты. Примеры сильных кислот включают серную, соляную и хлороводородную кислоты. Слабые кислоты, с другой стороны, не полностью диссоциируются в воде и существуют в виде равновесной смеси ионизированных и неионизированных молекул. Примеры слабых кислот включают уксусную, угольную и молочную кислоты.
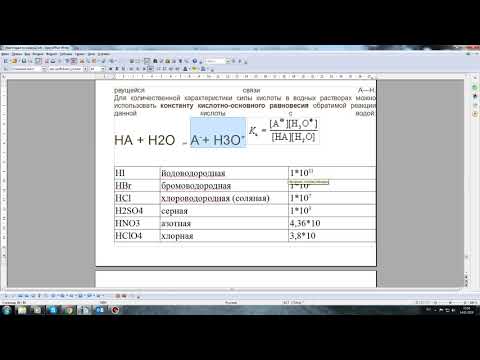
Сильные и слабые кислоты отличаются величиной константы ионизации (Kа). У сильных кислот Kа очень большая, поэтому они полностью ионизируются в воде. В случае слабых кислот Kа небольшая и они не полностью диссоциируются.
Знание о том, какие кислоты являются слабыми электролитами, очень полезно для понимания химических реакций, многих биологических процессов и соединений, которые мы встречаем в повседневной жизни.
Сильные и слабые кислоты
Кислоты могут быть разделены на две основные категории: сильные и слабые электролиты. Сильные кислоты полностью диссоциируют в воде, образуя большое количество ионов водорода (H+).
Примерами сильных кислот являются соляная кислота (HCI), серная кислота (H2SO4) и азотная кислота (HNO3). Когда они растворяются в воде, они полностью распадаются на ионы H+ и соответствующие анионы.
Слабые кислоты, напротив, не диссоциируют полностью в воде и образуют меньшее количество ионов H+. Они могут оставаться в виде молекул в водном растворе.
Примерами слабых кислот являются уксусная кислота (CH3COOH), молочная кислота (C3H6O3) и фосфорная кислота (H3PO4). Когда эти кислоты растворяются в воде, они диссоциируют только частично, оставаясь в виде как ионов H+, так и недиссоциированных молекул.
Слабые кислоты имеют более слабое влияние на pH растворов, так как они распадаются в меньшем количестве ионов H+. В то же время, сильные кислоты, такие как соляная кислота, могут служить сильными окислителями и обладают более низким pH.
Понимание различий между сильными и слабыми кислотами важно для химических реакций и установления равновесия в системе. В зависимости от конкретной задачи и контекста, какая-то кислота может быть сильным или слабым электролитом, и определение ее свойств является ключевым фактором в проведении многих химических экспериментов и процессов.
🔥 Видео
Неорганика исключения: как запомнить сильные и слабые кислоты | Химия ЕГЭ | Лия Менделеева УМСКУЛСкачать

9.Сильные и слабые кислотыСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Сильные и слабые электролиты | Химия с Сашей Сильвер | ЕГЭ 2024 | SMITUPСкачать

Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

Теории кислот, оснований и растворов. Теория Брёнстеда-Лоури. 11 класс.Скачать

сильные и слабые электролиты РАСЧЕТ рНСкачать

Карбоновые кислоты - слабые электролитыСкачать

Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать

Электропроводность сильных и слабых электролитовСкачать

Понятие электролита. Сильные и слабые электролиты. Диссоциация. Степень диссоциации | ХимияСкачать

Карбоновые кислоты – слабые электролитыСкачать

кислоты как электролиты/химия 9 классСкачать

Сильные и слабые кислотыСкачать
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

