Атомы являются основными строительными блоками материи и состоят из нейтронов, протонов и электронов. В обычном состоянии атом имеет равное количество положительно заряженных протонов и отрицательно заряженных электронов, что делает его электронейтральным. Однако, в некоторых случаях, атом может быть либо ионом с избыточным положительным зарядом, либо с избыточным отрицательным зарядом.
Одной из ситуаций, когда атом становится электронейтральным, является наличие равного числа электронов и протонов. Это ситуация, которая наблюдается в обычном неизмененном атому, где количество положительных зарядов равно количеству отрицательных зарядов, и их взаимодействие компенсирует друг друга, делая атом электронейтральным.
Еще одна ситуация, когда атом становится электронейтральным, происходит при образовании ионов. Когда атому приходится передавать или получать электроны от других атомов, чтобы достичь стабильной электронной конфигурации, он может временно стать ионом с положительным или отрицательным зарядом. Однако, когда ион связывается с другими ионами или атомами, электронные заряды снова компенсируются, делая атомы электронейтральными.
Видео:Строение атома. Объяснение электрических явлений | Физика 8 класс #10 | ИнфоурокСкачать

Когда атом становится электронейтральным в 8 классе
Атом становится электронейтральным, когда число электронов, окружающих его ядро, равно числу протонов в ядре. Это происходит в ситуации, когда атом находится в своем нормальном, устойчивом состоянии без какого-либо внешнего воздействия.
Чтобы легче понять, когда и как атом становится электронейтральным, следует рассмотреть его строение. Атом состоит из электронов, протонов и нейтронов. Протоны находятся в ядре атома, а электроны располагаются на оболочках вокруг ядра. Количество электронов в атоме определяется его атомным номером в периодической системе химических элементов.
Основное правило, определяющее количество электронов на каждой оболочке, — правило восми. Согласно этому правилу, первая оболочка может содержать не более 2 электронов, вторая — не более 8 электронов, третья — не более 18, четвертая — не более 32 и т.д.
Восьмой класс включает в себя изучение внешней оболочки атома и ее роли в связывании атомов и образовании молекул. Внешняя оболочка содержит валентные электроны, которые определяют химические свойства атома и его способность образовывать химические связи.
Электронейтральность атома обеспечивает его стабильность и устойчивость. Восьмой класс поможет учащимся понять, как атомы соединяются друг с другом, образуя молекулы. Ученикам предстоит изучить основные типы связей между атомами, включая ковалентную, ионную и металлическую связи.
Научившись определять электронейтральность атома и понимать его внешнюю оболочку, ученики смогут объяснить многое из того, что происходит в химических реакциях и веществах. Восьмой класс предоставляет основы, на которых можно построить более сложные и глубокие знания в области химии.
Видео:ЭЛЕКТРИЧЕСКИЙ ЗАРЯД — Как Устроен Атом, Что такое Ион? // Физика 8 классСкачать

Внешняя оболочка атома
Внешняя оболочка атома играет важную роль в определении его химических свойств. Вся электронная структура атома состоит из электронов, которые находятся на разных энергетических уровнях или оболочках. Верхняя оболочка, также известная как валентная оболочка, имеет особенное значение, поскольку это наиболее удаленная от ядра и наиболее доступная для взаимодействия с другими атомами.
Валентная оболочка содержит электроны, которые обеспечивают возможность для образования химических связей и образования молекул. Число электронов в валентной оболочке определяет химические свойства атома и его склонность к реакциям. Атомы стремятся достичь электронной стабильности, то есть заполнить свою валентную оболочку, чтобы стать электронейтральными.
Электроны в валентной оболочке размещаются в энергетических подуровнях, которые имеют различную форму и энергию. Эти подуровни обозначаются буквами s, p, d, f. Валентная оболочка может содержать до 8 электронов для элементов второго периода и до 18 электронов для элементов третьего периода и выше.
Распределение электронов в атоме определяется его электронной конфигурацией. Электроны в атоме заполняют оболочки по правилу «наименьшая энергия вначале». Это означает, что электроны заполняют подуровни с наименьшей энергией, прежде чем переходить к более высоким уровням энергии.
Валентная оболочка и электронная конфигурация атома определяют его химические свойства и взаимодействие с другими атомами для образования химических соединений. Молекулы образуются, когда атомы соединяются, чтобы общими усилиями достичь электронной стабильности путем обмена, присоединения или деления электронов.
Валентная оболочка является ключевым понятием в химии и играет важную роль в понимании свойств и реакций атомов. Понимание его роли и характеристик помогает объяснить многочисленные явления химической связи и образования соединений между атомами.
Распределение электронов в атоме
Атом состоит из ядра и облака электронов, которое окружает его. Облако электронов состоит из электронных оболочек. Каждая оболочка может вмещать определенное количество электронов.
Распределение электронов в оболочках атома происходит по правилам заполнения электронных оболочек. Первая оболочка может содержать не более 2 электронов, вторая — не более 8 электронов, третья — не более 18 электронов и так далее. Каждая следующая оболочка имеет больший радиус и энергию, чем предыдущая.
Распределение электронов в атоме происходит согласно принципам заполнения оболочек. Сначала заполняются оболочки с меньшим радиусом и энергией, затем — следующие оболочки по порядку возрастания радиуса и энергии.
Например, водород (H) имеет одну электронную оболочку, и на ней находится 1 электрон. Гелий (He) имеет две электронные оболочки, на первой оболочке находится 2 электрона и вторая оболочка пуста. Литий (Li) имеет три электронные оболочки, на первой оболочке находится 2 электрона, на второй — 1 электрон, а на третьей оболочке пока нет электронов.
Таким образом, распределение электронов в атоме происходит по определенным правилам, которые зависят от порядка заполнения оболочек и возрастания радиуса и энергии каждой оболочки. Это распределение определяет химические свойства атома и его возможность образовывать химические связи с другими атомами для образования молекул.
Порядок наполнения оболочек атома
Всего в атоме имеется несколько оболочек, обозначаемых буквами K, L, M, N и т.д. Первая оболочка K может вместить до 2 электронов, вторая оболочка L — до 8 электронов, третья оболочка M — также до 8 электронов, и так далее.
Порядок наполнения оболочек определяется следующим образом: сначала заполняется первая оболочка K, затем оболочка L, М и так далее. Каждая оболочка заполняется электронами по принципу минимизации энергии, то есть наиболее близкие к ядру энергетические уровни заполняются первыми.
Например, для атома кислорода с атомным номером 8, первая оболочка K будет содержать 2 электрона, вторая оболочка L — 6 электронов, все остальные оболочки останутся пустыми. Это связано с тем, что первый уровень энергии находится ближе к ядру и, следовательно, его энергетических состояний меньше.
Важно отметить, что порядок наполнения оболочек может изменяться в некоторых исключительных случаях, когда речь идет о периодической системе элементов. Например, в периоде переходных элементов зачастую заполняется оболочка d до заполнения оболочки s. Также некоторые элементы могут иметь дополнительные оболочки, которые заполняются после основных.
Видео:8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Высокая и низкая электроотрицательность
Высокая электроотрицательность характерна для таких элементов, как кислород, фтор, хлор и азот. Эти элементы имеют тенденцию притягивать к себе электроны при образовании химических связей. Они обычно образуют отрицательно заряженные ионы, принимая электроны от других элементов.
Низкая электроотрицательность характерна для таких элементов, как литий, натрий и калий. Эти элементы имеют меньшую тенденцию притягивать электроны и обычно образуют положительно заряженные ионы за счет отдачи своих электронов другим элементам.
Разность электроотрицательностей между атомами в молекуле влияет на характер образуемых химических связей. Если разность электроотрицательностей между атомами невелика, то связь будет неполярной, если же разность большая — связь будет полярной.
Смещение заряда происходит в полярной химической связи, когда один атом притягивает электроны сильнее, чем другой. В результате один атом образует положительный заряд, а другой — отрицательный заряд. Это создает неравномерное распределение заряда в молекуле и делает ее полярной.
Высокая и низкая электроотрицательность важны для понимания свойств веществ и их реакций. Они определяют, какие соединения будут образовываться и как будет протекать химическая реакция между атомами. Понимание этих понятий помогает предсказывать свойства веществ и их взаимодействия в химических реакциях.
Разность электроотрицательностей
ЭО атомов определяется по шкале Полинга, где каждому химическому элементу присваивается определенное значение электроотрицательности. Наиболее электроотрицательным элементом считается флуор, у которого значение ЭО равно 4.0. В то время как щелочные металлы, такие как литий или натрий, имеют низкую электроотрицательность около 1.0.
Разность электроотрицательностей между двумя атомами может варьироваться от 0 до 4.0. Чем больше эта разность, тем сильнее полярная связь между атомами. Если разность электроотрицательностей меньше 0.5, то связь между атомами считается неполярной, если от 0.5 до 1.7 — полярной, а если больше 1.7 — ионной.
Разность электроотрицательностей влияет на свойства веществ, такие как температура плавления и кипения, вязкость, растворимость и др. Наличие полярных связей в молекуле приводит к образованию диполей, что способствует образованию межмолекулярных сил.
Таблица электроотрицательностей помогает оценить возможность образования полюсных связей между атомами различных элементов и прогнозировать их свойства и реакционную способность. Знание разности электроотрицательностей может быть полезным для студентов при изучении химии и понимании принципов химических реакций и связей между атомами.
| Химический элемент | Электроотрицательность |
|---|---|
| Флуор | 4.0 |
| Кислород | 3.5 |
| Хлор | 3.0 |
| Азот | 3.0 |
| Углерод | 2.5 |
| Водород | 2.1 |
| Литий | 1.0 |
| Натрий | 0.9 |
Смещение заряда
При смещении заряда положительный заряд сосредотачивается в одной части молекулы, а отрицательный заряд — в другой. Это создает положительные и отрицательные полюса. Положительные и отрицательные полюса могут притягивать друг друга, образуя между собой химическую связь.
Смещение заряда играет важную роль в образовании различных видов химических связей, таких как ионная связь и ковалентная связь. В ионной связи электроотрицательный атом отдает электрон другому атому с меньшей электроотрицательностью, создавая положительный и отрицательный ион. В ковалентной связи электроотрицательные атомы делят пару электронов между собой, создавая общее облако электронов и образуя молекулу.
Смещение заряда также влияет на свойства веществ, такие как электропроводность и растворимость. Молекулы с ионной связью обычно растворяются в воде, так как положительные и отрицательные ионы притягиваются к полярной молекуле воды. Однако молекулы с ковалентной связью, где электроотрицательность атомов более равномерна, обычно менее растворимы или вообще не растворяются в воде.
Важно помнить, что смещение заряда в молекуле является неравновесным состоянием и может изменяться под влиянием различных условий, таких как температура и давление. Изменение смещения заряда может привести к изменению свойств вещества и способности к образованию связей с другими атомами или молекулами.
Видео:ХИМИЯ строение атома и СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК атомов 8 классСкачать

Молекулы и их связи
Связи между атомами в молекуле могут быть различными: ковалентными, ионными, металлическими и водородными. Ковалентная связь — это совместное использование электронов внешних оболочек атомов для образования пар электронных облаков между ними.
Связи в молекулах могут быть одиночными, двойными или тройными в зависимости от количества электронных пар, которые разделяют атомы. Это определяет длину и прочность связи между атомами.
Молекулы обладают свойствами, которые зависят от типа связей и взаимного расположения атомов. Например, ковалентные связи обладают высокой степенью прочности и имеют большую энергию связи.
Ионные связи между атомами создаются при передаче или приеме электронов. Атом, отдавший электроны, становится положительно заряженным и называется катионом, а атом, принявший электроны, становится отрицательно заряженным и называется анионом.
Металлические связи характерны для металлов. В таких связях электроны в валентной оболочке атома могут свободно двигаться между атомами, создавая электронное облако или «море электронов».
Водородные связи — это слабые связи, которые возникают между молекулами вещества на основе водорода. Они играют важную роль в формировании трехмерной структуры молекул и свойствах многих веществ.
Понимание связей между атомами и молекулами помогает объяснить множество явлений в химии и биологии. Изучение молекул и их связей позволяет более глубоко понять строение вещества и его свойства, а также создавать новые материалы с определенными свойствами.
📹 Видео
СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Энергетические уровни. 8 класс.Скачать

Движение электронов в атоме. 1 часть. 8 класс.Скачать

Чем атом отличается от иона?Скачать

Почему ИЗОТОПЫ изменят мир? (химия для начинающих)Скачать

Лучшая модель атома? [Минутка физики]Скачать
![Лучшая модель атома? [Минутка физики]](https://i.ytimg.com/vi/eybcxXiYJfc/0.jpg)
5. Строение вещества. Атомы и молекулы (часть 1)Скачать

Возбужденное состояние атома | Химия ЕГЭ | УмскулСкачать

Физика 8 класс (Урок№12 - Строение атомов. Ионы. Природа электризации тел. Электрическое поле.)Скачать

Габриелян О. С. 8 класс §8 "Изменения в составе ядер атомов химических элементов. Изотопы"Скачать

Видеоролик - анимация "Строение атома и ядра"Скачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Электроотрицательность химических элементов. 8 класс.Скачать
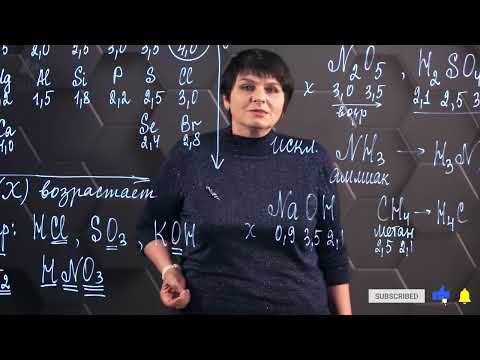
Образование ионов. 8 класс.Скачать

Объяснение электрических явлений. Видеоурок 18. Физика 8 классСкачать

8 Класс. Распределение электронов в атоме | Электронные формулы - ПОЙМЁТ КАЖДЫЙСкачать

