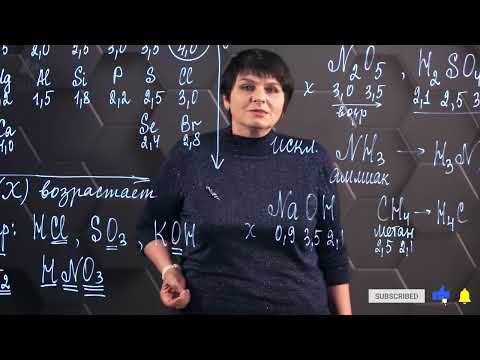Ковалентная связь – это один из основных типов химических связей, в основу которой лежит общее использование внешних электронов атомами. Она возникает между неметаллическими элементами таблицы Менделеева. В ковалентной связи два атома обмениваются парами электронов, образуя молекулу. Такие связи обладают высокой прочностью и устойчивостью.
Какие элементы образуют ковалентную связь между атомами? Ковалентные связи могут формироваться между атомами неметаллов, таких как углерод (С), кислород (О), азот (N), фтор (F), хлор (Cl) и другие. Эти элементы обладают высокой электроотрицательностью и стремятся заполнить свою внешнюю оболочку электронами, чтобы достичь стабильной октетной конфигурации.
Ковалентные связи основаны на принципах распределения электронных пар в пространстве между атомами. Межатомное расстояние в молекуле зависит от силы ковалентной связи – чем выше энергия связи, тем короче межатомное расстояние. Ковалентные связи также могут быть полярными или неполярными, в зависимости от разности электроотрицательности атомов. В полярных связях электронная плотность смещается ближе к атому с большей электроотрицательностью.
- Ковалентная связь и ее образование
- Определение и принцип работы ковалентной связи
- Определение и химический процесс образования ковалентной связи
- Основные принципы ковалентной связи
- 6. Элементы, образующие ковалентную связь
- Ковалентная связь в органических соединениях
- Ковалентная связь в органических соединениях — Углерод
- Ковалентная связь в органических соединениях — Водород
- 🌟 Видео
Видео:Ковалентная Неполярная Связь — Химическая связь // Химия 8 классСкачать

Ковалентная связь и ее образование
Образование ковалентной связи происходит в результате того, что атомы стремятся достичь более стабильного энергетического состояния. При этом они могут обменивать электроны или делить их парой. В результате такого взаимодействия оба атома становятся электроно-нейтральными и образуют устойчивую молекулу.
Образование ковалентной связи можно объяснить с помощью теории электронных пар. Согласно этой теории, внешняя электронная оболочка атомов содержит электронные пары, которые используются для образования связи. Каждый атом может участвовать в образовании связи, внося одну или несколько электронных пар. Это позволяет атомам обмениваться электронами таким образом, чтобы оба атома получили заполненные электронные оболочки.
Основными принципами образования ковалентной связи являются электронный октет и правило Вальенса. Согласно правилу Вальенса, атомы могут обменивать электроны таким образом, чтобы каждый из них имел восемь электронов в внешней оболочке или два электрона, если их внешняя оболочка имеет только один электрон.
| Атом | Электроны в внешней оболочке | Состояние до образования связи | Состояние после образования связи |
|---|---|---|---|
| Кислород (O) | 6 | ⚫ ⚫ ⚫ ⚫ ⚫ ⚫ | ⚫ ⚫ ⚪ ⚪ ⚪ ⚪ O |
| Водород (H) | 1 | ⚫ | ⚪ H |
| Водород (H) | 1 | ⚫ | ⚪ H |
Например, рассмотрим образование молекулы воды (H2O). В молекуле воды один атом кислорода образует две ковалентные связи с атомами водорода. Кислород обменивает свои две электронные пары с одной электронной парой каждого атома водорода, что позволяет всем атомам получить заполненные электронные оболочки.
Видео:Ковалентная Полярная Связь — Химическая связь // Химия 8 классСкачать

Определение и принцип работы ковалентной связи
Принцип работы ковалентной связи заключается в том, что два атома могут совместно использовать пару электронов, чтобы достичь наиболее стабильной электронной конфигурации. Когда атомы делят электроны, они становятся связанными и образуют молекулу. Ковалентная связь может быть одинарной, двойной или тройной в зависимости от количества электронных пар, которые между атомами обмениваются.
Ковалентная связь является очень сильной связью, которая обеспечивает стабильность молекул и веществ. Это позволяет атомам образовывать разнообразные структуры и химические соединения. Ковалентные связи определяют множество физических и химических свойств вещества, таких как его плотность, температура плавления и кипения, электропроводность и растворимость.
Определение и химический процесс образования ковалентной связи
Химический процесс образования ковалентной связи происходит следующим образом:
- Два атома приближаются друг к другу до определенного расстояния, так чтобы их внешние оболочки перекрывались.
- Электроны из внешних оболочек атомов начинают образовывать общую электронную пару, которая совместно принадлежит обоим атомам.
- После образования общей электронной пары, атомы становятся электронейтральными и образуют ковалентную связь.
В результате образования ковалентной связи, атомы становятся более стабильными и образуют молекулы или соединения, которые имеют определенные физические и химические свойства.
Этот процесс особенно важен в органической химии, где большинство соединений состоят из углеродных атомов, образующих многочисленные ковалентные связи с другими элементами, такими как водород, кислород, азот и др.
| Элементы, образующие ковалентную связь | Примеры соединений |
|---|---|
| Углерод | Метан (CH4), этан (C2H6), бензол (C6H6) |
| Водород | Вода (H2O), аммиак (NH3), метанол (CH3OH) |
| Кислород | Диоксид углерода (CO2), вода (H2O), озон (O3) |
Исследование ковалентной связи и ее процесса образования позволяет лучше понять структуру и свойства различных веществ, а также использовать их в промышленности, медицине и других областях.
Основные принципы ковалентной связи
- Общий электронный пар: когда два атома приближаются друг к другу, и их электронные оболочки перекрываются, образуется общий электронный пар.
- Совместное использование электронов: оба атома вносят вклад в образование ковалентной связи, деля электроны между собой.
- Поддержка стабильности: образование ковалентной связи помогает атомам достичь более стабильного состояния, заполнив свои электронные оболочки.
Важно отметить, что сила ковалентной связи зависит от электроотрицательности атомов. Если электроотрицательности атомов близки, то ковалентная связь будет более сильной.
Ковалентная связь является одним из основных типов связей в химии и играет важную роль в образовании различных соединений, включая органические соединения.
Видео:Ковалентная связь. 8 класс.Скачать
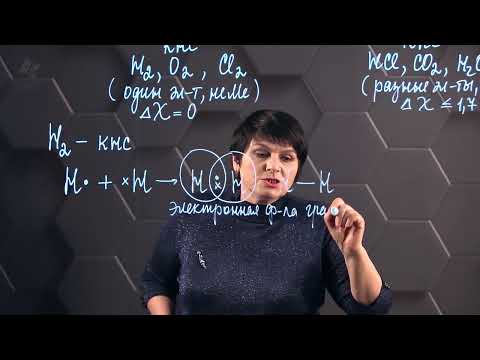
6. Элементы, образующие ковалентную связь
Ковалентная связь возможна между различными элементами, однако некоторые из них образуют более стабильные и распространенные соединения. Вот некоторые из основных элементов, образующих ковалентную связь:
| Элемент | Примеры соединений |
|---|---|
| Кислород (O) | Вода (H2O), углекислый газ (CO2), пероксид водорода (H2O2) |
| Углерод (C) | Метан (CH4), этан (C2H6), бензол (C6H6) |
| Водород (H) | Аммиак (NH3), метан (CH4), водородное соединение (HCl) |
| Азот (N) | Аммиак (NH3), азотная кислота (HNO3), нитрат аммония (NH4NO3) |
| Фосфор (P) | Фосфин (PH3), фосфаты (PO43-) |
Эти элементы образуют различные соединения и играют важную роль в химических реакциях. Ковалентная связь между ними обусловлена способностью атомов разделять электроны и удерживать их общими.
Видео:Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

Ковалентная связь в органических соединениях
Ковалентная связь играет особую роль в органической химии, где она образуется между атомами углерода и других элементов. Органические соединения состоят из молекул, в которых атомы связаны ковалентными связями. Эти связи обеспечивают стабильность и уникальные химические свойства органических соединений.
Ковалентная связь в органических соединениях основана на обмене электронами между атомами. Атомы в молекуле органического соединения делят электроны, чтобы удовлетворить потребности своих электронных оболочек. Ковалентная связь между атомами формируется при перекрытии их электронных орбиталей.
В органических соединениях наиболее распространенной ковалентной связью является связь между углеродом и другими элементами, такими как водород, кислород, азот и многие другие. Углерод является уникальным элементом, способным образовывать четыре ковалентные связи. Благодаря этому свойству углерод способен образовывать разнообразные химические соединения, что делает органическую химию наукообразующей.
Водород также часто участвует в ковалентных связях с углеродом в органических молекулах. Эта связь обычно является одиночной и образуется при соединении водорода с атомом углерода. Цепочки из повторяющихся углеродно-водородных связей, называемых углеводородными цепями, являются основой многих органических соединений, таких как алканы, алкены и алкины.
Ковалентная связь в органических соединениях — Углерод
Углерод образует четыре ковалентные связи, что позволяет ему образовывать множество различных структур. Именно благодаря этому свойству углерода существует огромное количество органических соединений — от простых молекул, таких как метан и этан, до сложных полимерных цепей и биомолекул, таких как белки и ДНК.
Ковалентная связь между атомами углерода и других элементов играет ключевую роль в органической химии. Она образуется путем совместного использования электронов атомами углерода и других элементов, что обеспечивает стабильность и устойчивость молекул органических соединений.
Углеродный скелет органических соединений может быть прямым или ветвистым, атомы углерода могут образовывать одинарные, двойные или тройные связи между собой и с другими атомами. Все эти различные комбинации образуют основу разнообразия органической химии и определяют свойства и функции соединений.
Углерод является основой жизни на Земле, так как большинство органических соединений состоит из углерода. Органические соединения играют важную роль в биологии, медицине, пищевой промышленности и других отраслях науки и промышленности. Понимание ковалентной связи углерода и его роли в образовании органических соединений является фундаментальным для понимания мира живых систем и химических процессов.
Ковалентная связь в органических соединениях — Водород
Ковалентная связь играет важную роль в органической химии, а особенно в связи с атомом водорода.
Водород, химический элемент с атомным номером 1, образует ковалентные связи с другими элементами, такими как углерод, кислород, азот и многими другими. Эти связи обычно являются одинарными, то есть водород образует одну связь с другим атомом.
Однако в некоторых случаях водород может образовывать двойные и тройные связи. Например, в органических соединениях, таких как алкены и алкины, водород может быть связан с атомами углерода двумя или тремя ковалентными связями.
Ковалентная связь между водородом и другими элементами играет важную роль во многих химических реакциях. Например, водород может участвовать в реакциях гидрирования, где углеродные соединения добавляются водородом для образования более сложных структур.
Также водород может образовывать водородные связи, которые являются более слабыми, но более направленными связями по сравнению с обычными ковалентными связями. Эти связи играют важную роль в стабилизации пространственной структуры белков и нуклеиновых кислот.
Органическая химия, изучающая соединения содержащие углерод, является обширной областью научных исследований и играет важную роль в многих аспектах нашей жизни, от фармацевтической промышленности до изучения биологических процессов.
Таким образом, ковалентная связь между водородом и другими элементами в органических соединениях представляет собой важный аспект в химии и имеет широкий спектр применений и значений в нашей жизни.
🌟 Видео
Химия 8 класс (Урок№30 - Ковалентная химическая связь. Полярная и неполярная ковалентная связь.)Скачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Ионная, ковалентная и металлическая связиСкачать

Ионная, ковалентная и металлическая связи | Химия. ВведениеСкачать

Ковалентная химическая связь | Химия 11 класс #4 | ИнфоурокСкачать

8 класс.Химическая связь.Скачать

Определяем тип химической связиСкачать

Ковалентная связь. 1 часть. 10 класс.Скачать

Ионная, ковалентная и металлическая связи | Типы химической связиСкачать

Ковалентная связь. 2 часть. 10 класс.Скачать

Самый простой способ понять ХИМИЮ — Типы Кристаллических Решеток и Свойства ВеществаСкачать

Химия. Химическая связь. Ковалентная связь и ее характеристики. Центр онлайн-обучения «Фоксфорд»Скачать

8. Виды химической связи.Скачать

37. Что такое ковалентная связьСкачать

56. Типы химических связей. Ковалентная связьСкачать

Электроотрицательность химических элементов. 8 класс.Скачать