Белки — основные структурные единицы живых организмов, выполняющие множество функций. Их первичная структура определяется последовательностью аминокислотных остатков, связанных между собой пептидными связями. Эта последовательность играет ключевую роль в определении формы и функции белка.
Существуют несколько типов связей, определяющих первичную структуру белка. Одной из наиболее распространенных является пептидная связь, образующаяся между аминогруппой одной аминокислоты и карбоксильной группой другой. Эта связь обладает высокой устойчивостью и играет важную роль в стабилизации трехмерной структуры белка.
Важной особенностью пептидной связи является сопряженность плоскостей атомов, образующих связь. Это позволяет образовывать упорядоченные пространственные структуры, такие как альфа-спираль или бета-складка. Также пептидная связь обеспечивает гибкость белковой цепи, позволяя ей принимать различные конформации.
Видео:Первичная структура белкаСкачать

Виды связей, определяющих первичную структуру белка
1. Пептидные связи: Пептидные связи образуются между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты. Эта связь является основной в первичной структуре белка и обусловливает последовательность аминокислотных остатков.
2. Дизульфидные связи: Дизульфидные связи образуются между двумя цистеиновыми остатками. Они связывают боковые цепи аминокислот и способствуют формированию пространственной структуры белка.
3. Гликозильные связи: Гликозильные связи образуются между углеводными остатками и аминокислотными остатками. Они играют важную роль в построении гликопротеинов и определяют их функции и свойства.
4. Водородные связи: Водородные связи образуются между водородными атомами и электроотрицательными атомами, такими как азот, кислород и фосфор. Они участвуют в формировании вторичной структуры белка, такой как α-спираль и β-складка.
Водородные связи между аминокислотными остатками: Водородные связи между аминокислотными остатками обуславливают укладку белковой структуры и стабилизируют пространственную конформацию белковой молекулы.
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Химические связи
Химические связи играют основополагающую роль в формировании первичной структуры белка. Они определяют порядок и последовательность аминокислотных остатков в полипептидной цепи.
Самой важной химической связью, отвечающей за формирование первичной структуры белка, является пептидная связь. Она образуется между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты при слиянии двух остатков в полипептидной цепи. Пептидная связь является основой для образования полипептидной цепи и определяет последовательность аминокислот в белке.
Другой важной химической связью является дизульфидная связь. Она образуется между двумя цистеиновыми остатками при окислительной реакции. Дизульфидные связи могут участвовать в формировании пространственной структуры белка и обеспечивать его стабильность.
Гликозильные связи также имеют значительное значение в образовании первичной структуры белка. Они образуются при присоединении углеводов к белковым остаткам и могут влиять на функциональные свойства белка.
Водородные связи являются слабыми химическими связями, которые могут образовываться между аминокислотными остатками в белке. Они способствуют стабилизации пространственной структуры белка и играют важную роль в его функционировании.
В целом, химические связи играют ключевую роль в формировании первичной структуры белка. Они определяют последовательность аминокислот в полипептидной цепи и могут влиять на его пространственную структуру и функциональные свойства.
Пептидные связи
Пептидная связь имеет плоскую геометрию, так как атомы углерода, азота и кислорода лежат в одной плоскости. Это позволяет белкам образовывать различные вторичные и третичные структуры, такие как альфа-спираль, бета-складка и другие. Эти структуры определяют свойства и функции белков.
Пептидная связь характеризуется своей жесткостью и плоскостью, которые обусловливают возможность образования положительных и отрицательных ионов. Влияние различных факторов, таких как температура, pH и внешние силы, могут привести к разрыву пептидной связи.
Установление последовательности аминокислот в полипептидной цепи основано на генетической информации. Каждая аминокислота в белке кодируется определенным нуклеотидным тройственным кодом в генетической последовательности ДНК. Таким образом, пептидные связи играют ключевую роль в формировании уникальной последовательности аминокислот в белковой цепи, что определяет их функциональные свойства.
| Пептидная связь | -CO-NH- |
| Символ | — |
| Формула | C=O + NH |
Дизульфидные связи
Дизульфидные связи играют важную роль в структуре белков и их функциональных свойствах. Они служат для укрепления пространственной структуры белка и обеспечивают его стабильность и устойчивость к внешним воздействиям.
Образование дизульфидных связей происходит в процессе окисления атомов серы при воздействии окислительного средства. Отсюда следует, что дизульфидные связи могут играть роль биохимического маркера окислительного стресса в организме.
Дизульфидные связи могут быть разрушены в процессе денатурации белка, что приводит к потере его функций. Однако, в некоторых случаях разрушение дизульфидных связей может быть обратимым, и белок может восстанавливать свою структуру и функции при благоприятных условиях.
Изучение дизульфидных связей и их роли в биологических процессах является одной из актуальных задач современной биохимии и молекулярной биологии. Понимание механизмов образования и разрушения дизульфидных связей позволяет лучше понять структуру и функции белков, а также помогает разрабатывать новые методы лечения заболеваний, связанных с нарушением их активности.
Гликозильные связи:
Гликозильные связи представляют собой ковалентные связи, образующиеся между углеродными атомами аминокислот и углеродными атомами моносахаридов. Они обладают высокой стабильностью и устойчивостью, что позволяет им существовать в течение длительного времени.
Гликозильные связи играют важную роль в структуре и функции белка. Они могут влиять на его трехмерную конформацию, а также на его способность связываться с другими молекулами. Гликозиляция может также служить сигналом для других молекул, участвующих в биологических процессах, и играть роль в регуляции и контроле метаболических путей.
Гликозильные связи могут быть как одиночными, так и множественными. Они могут образовываться в различных частях белковой структуры, в том числе в области активного центра или на поверхности белка. Их наличие и месторасположение могут существенно влиять на функцию белка и его взаимодействие с другими молекулами.
Таким образом, гликозильные связи являются ключевым элементом первичной структуры белка. Они обладают высокой стабильностью и играют важную роль в его функции и взаимодействии с другими молекулами.
Видео:Вторичная структура белкаСкачать
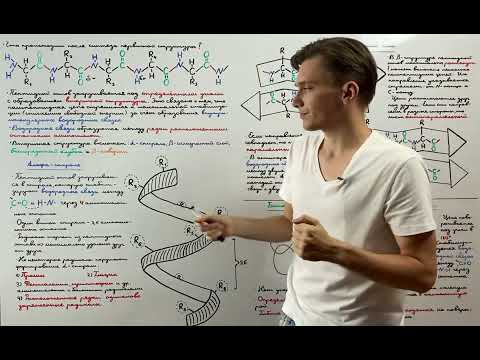
Водородные связи
Водородные связи между аминокислотными остатками являются ключевыми элементами в формировании вторичной структуры белка, такой как α-спираль (а-геликс) и ß-складка. Водородные связи образуются между аминокислотными остатками, в которых атом водорода связан с электронно-отрицательными атомами кислорода или азота.
Силу водородных связей определяет разность электронных зарядов и расстояние между атомами. Водородные связи более слабы, чем ковалентные связи, но все же играют важную роль в конформационной стабильности белков. Они помогают белкам принимать определенную трехмерную структуру, а также участвуют в ряде биологических процессов, таких как сворачивание и разворачивание белка, связывание субстратов и белковых комплексов.
Водородные связи могут быть легко нарушены под воздействием факторов, таких как температура, растворители, изменения pH и другие физические или химические условия. Изменение водородных связей может привести к изменению трехмерной структуры белка и его функций. Поэтому понимание водородных связей является ключевым для понимания структуры и функции белков.
| Виды аминокислот | Виды водородных связей |
|---|---|
| Аспарагин (Asn) | 2 водородные связи |
| Глутамин (Gln) | 2-3 водородные связи |
| Серин (Ser) | 2 водородные связи |
| Треонин (Thr) | 2 водородные связи |
| Тирозин (Tyr) | 2 водородные связи |
Водородные связи – важные элементы, обеспечивающие стабильность и формирование трехмерной структуры белка. Они образуются между атомами водорода и электронно-отрицательными атомами и позволяют белкам принимать определенную конформацию. Понимание водородных связей помогает раскрыть механизмы белковых функций и процессов, в которых они участвуют.
Водородные связи между аминокислотными остатками
Водородные связи играют важную роль в формировании первичной структуры белка. Они образуются между аминокислотными остатками и способствуют установлению взаимодействий между ними.
Водородные связи образуются между электронными облаками различных атомов, в данном случае между атомом водорода и атомом азота, кислорода или серы. Атом водорода образует положительный заряд, который притягивается к отрицательному заряду атомов азота, кислорода или серы. Таким образом, образуется водородная связь, которая придает молекуле стабильность и пространственное упорядочение.
Водородные связи между аминокислотными остатками играют важную роль в формировании вторичной структуры белка. Они способствуют образованию структурных элементов, таких как α-спираль и β-складка.
Например, вода или растворы воды могут быть использованы для создания водородных связей между аминокислотными остатками. Это важное свойство можно использовать при исследовании структуры и функции белков, а также при разработке новых препаратов и лекарственных средств.
📹 Видео
Как устроена первичная структура белка? Душкин объяснитСкачать

Строение и функции белков.Скачать

Биохимия. Лекция 2. Белки. Уровни организации белков. Функции белков.Скачать

Строение и уровни структурной организации белков. 10 класс.Скачать

Биосинтез белка за 3 минуты (даже меньше)Скачать

Четвертичная структура белкаСкачать

Структура белковой молекулы. БиохимияСкачать

Биохимия | Строение белков часть 1Скачать

Структура ДНКСкачать

Аминокислоты, белки. Строение белков. Уровни организации белковой молекулы. Видеоурок по биологии 10Скачать

Обзор структуры белка (видео 10) | Макромолекулы | БиологияСкачать
Биохимия. Конформация белков. Фолдинг белков.Скачать

Строение белка. Уровни организации белковой молекулы.Скачать
Третичная структура белка (видео 11) | Макромолекулы | БиологияСкачать

Структуры белкаСкачать

Что такое фолдинг белков? Душкин объяснитСкачать

Структура белка молекулярная биология с Алиповым (лекция 8)Скачать

