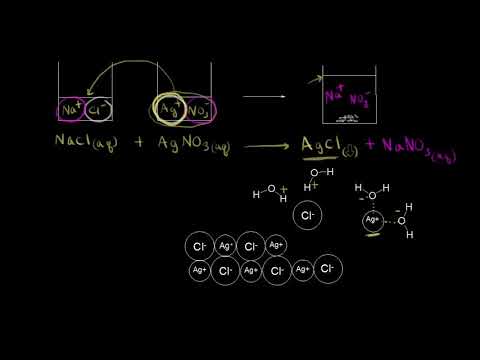
В химических реакциях не только происходит образование новых веществ, но и возникает множество интересных физических явлений. Одним из таких явлений является образование осадка при взаимодействии растворов различных веществ. Это процесс, который проводится для изучения особенностей химических взаимодействий и позволяет наблюдать формирование новых веществ и их выделение в виде мелких частиц, которые оседают на дне раствора.
Осадок — это твердое вещество, которое образуется в результате химической реакции между двумя или более растворами. Образование осадка происходит благодаря образованию новых соединений, которые не растворяются в данной среде. Это своеобразное «видение» реакции, которое позволяет исследователям увидеть, как вещества переходят из одного состояния в другое, и сохранить результаты реакции для анализа.
Важно знать, что образование осадка зависит от множества факторов, таких как концентрация растворов, температура и плотность растворов, а также pH-уровень. Нередко для проведения эксперимента применяют дополнительные вещества, такие как индикаторы, которые помогают визуально отследить процесс образования осадка.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Роль образования осадка в химических реакциях
Образование осадка играет важную роль в химических реакциях. Осадок представляет собой твердое вещество, которое образуется в результате реакции между двумя растворами.
Осадок может образовываться при взаимодействии различных соединений, таких как соли, оксиды, гидроксиды и другие. При этом происходит отделение твердых частиц от раствора, что приводит к образованию осадка.
Образование осадка является одним из важных шагов в многих химических процессах. Оно может происходить как в лаборатории, так и в природных условиях. Например, осадок может образовываться при процессе высокотемпературной обработки руд для извлечения металлов.
Различные факторы, такие как концентрация реагентов, температура, pH и наличие катализаторов, могут влиять на образование осадка. Эти факторы могут влиять на скорость реакции и тип образующегося осадка.
Механизм образования осадка может быть различным, в зависимости от реагентов и условий реакции. Он может включать образование нуклеусов, рост кристаллов и агрегацию частиц.
Образование осадка имеет широкое применение в аналитической химии. Осадочные реакции используются в качественном и количественном анализе для определения присутствия и концентрации определенных веществ. Например, осадочные реакции применяются для обнаружения и идентификации ионов в водных растворах.
В качестве заключения, образование осадка является важной частью химических реакций и находит различные применения в аналитической химии. Понимание роли образования осадка позволяет улучшить понимание химических процессов и применять их в практических целях.
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

3. Формирование осадка в химических процессах
Образование осадка возникает во время химических процессов, когда растворные вещества соединяются и образуют новые вещества, которые не растворяются в данном растворе и выпадают в виде нерастворимых частиц, называемых осадком. Этот процесс часто происходит при смешении двух растворов или при изменении условий, таких как изменение pH, температуры или концентрации реагентов.
Осадок может образовываться из-за различных химических реакций, включая обмен и осаждение ионов или образование новых соединений. Примерами таких реакций являются осаждение солей при смешивании растворов, образование осадка при нейтрализации кислоты и щелочи, а также образование осадка при окислении или восстановлении веществ.
Образование осадка в химических процессах может быть полезным в различных областях аналитической химии. Например, осадочные реакции могут использоваться для выделения и концентрирования искомого вещества или для разделения смесей соединений. Они также могут быть использованы для определения присутствия определенных ионов или соединений в образце.
Определение осадка, его свойств и характеристик является важным шагом в аналитической химии. Это позволяет исследователям понять происходящие химические реакции и разработать методы анализа и диагностики различных веществ и соединений.
Влияние различных факторов на образование осадка
1. Концентрация веществ в растворе.
Увеличение концентрации растворенных веществ способствует увеличению их взаимодействия и вероятности образования осадка. Следовательно, повышение концентрации может ускорить реакцию образования осадка.
2. pH раствора.
Кислотность или щелочность раствора может значительно влиять на образование осадка. Некоторые вещества образуют осадок только в определенном pH-диапазоне. Поэтому изменение pH раствора может привести к образованию или растворению осадка.
3. Температура раствора.
Температура также может влиять на образование осадка. При повышении температуры обычно увеличивается растворимость вещества, что может предотвратить образование осадка. Однако, в некоторых случаях, повышение температуры может способствовать образованию осадка путем изменения ионного равновесия.
4. Присутствие других веществ в растворе.
Наличие других веществ в растворе может существенно влиять на образование осадка. Некоторые вещества могут стимулировать образование осадка, выступая в качестве катализаторов или веществ, вызывающих искажение ионного равновесия. Другие вещества, наоборот, могут предотвратить образование осадка или растворить уже существующий осадок.
Все эти факторы тесно связаны между собой и могут сильно менять результаты очистки веществ или проведения различных химических реакций. Изучение влияния этих факторов на образование осадка является важным аспектом в области химии и аналитической химии.
Механизмы образования осадка
Основные механизмы образования осадка включают:
| Механизм | Описание |
|---|---|
| Флокуляция | Этот механизм основан на образовании частиц вещества в растворе, которые соединяются в более крупные агрегаты и формируют осадок. Флокуляция происходит под влиянием дополнительных веществ, называемых флокулянтами. |
| Пресипитация | Этот механизм основан на нерастворимости вещества в растворе при заданных условиях. Когда раствор с насыщенным растворимым веществом охлаждается или изменяется pH, вещество становится нерастворимым и образует осадок. |
| Ионно-обменный процесс | Этот механизм основан на обмене ионами между раствором и образующимся осадком. Один тип ионов из раствора замещается другими ионами, что приводит к образованию нерастворимых ионных соединений и образованию осадка. |
Механизм образования осадка зависит от свойств реагирующих веществ, условий реакции, наличия катализаторов и других факторов. Понимание этих механизмов позволяет улучшить контроль и оптимизацию процессов образования осадка, а также разработку новых методов и технологий в области химии и аналитической химии.
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Механизмы образования осадка
Механизмы образования осадка могут быть разнообразными и зависят от типа веществ, взаимодействующих в реакции.
1. Осаждение посредством образования ионных связей.
Один из часто встречающихся механизмов образования осадка – это образование ионных соединений. Во время химической реакции происходит образование нерастворимого вещества, которое обычно представляет собой соль металла или основание. Нерастворимое вещество оседает на дне сосуда, образуя осадок. Примером такой реакции может служить реакция между раствором серной кислоты и раствором карбоната натрия, в результате которой образуется осадок белого цвета – карбонат кальция.
Серная кислота + карбонат натрия → карбонат кальция + натриевая соль серной кислоты
2. Осаждение посредством образования координационных соединений.
Еще одним механизмом образования осадка – это образование координационных соединений. При этом в растворе образуется комплексное соединение, состоящее из центрального ионa и лигандов, которые образуют с ним связи с помощью донорно-акцепторного взаимодействия. Когда реакция достигает равновесия, координационное соединение становится нерастворимым и осаждается в виде осадка. Например, реакция между растворom никеля(II) сульфата и раствором аммиака приводит к образованию осадка сульфида никеля:
Никель(II) сульфат + аммиак → сульфид никеля + аммиак сульфат
3. Осаждение посредством изменения pH раствора.
Еще один способ образования осадка – это изменение pH раствора в результате взаимодействия кислоты и основания. При этом ионная соль, образованная в результате реакции, становится нерастворимой и осаждается. Например, при смешении растворов хлористого серебра и гидроксида аммония происходит образование осадка оксида серебра, обусловленное изменением pH раствора:
Хлористый серебра + гидроксид аммония → оксид серебра + хлорид аммония
Знание механизмов образования осадка имеет большое значение в аналитической химии, так как позволяет понять, какие реактивы использовать для обнаружения или определения определенного вещества в растворе.
Осадочные реакции в качественном анализе
Осадочные реакции играют важную роль в качественном анализе химических веществ. Эти реакции основаны на образовании осадка при смешении растворов различных веществ и позволяют провести идентификацию ионов в растворах.
Одним из основных применений осадочных реакций является определение наличия или отсутствия определенного иона в растворе. В качественном анализе используется множество осадочных реакций для определения ионов, таких как сульфаты, хлориды, карбонаты и другие.
Принцип осадочной реакции заключается в том, что при смешении двух растворов, содержащих ионы, которые могут реагировать между собой и образовывать нерастворимые вещества (осадки), происходит химическая реакция, которая приводит к образованию осадка. Этот осадок может быть обнаружен и идентифицирован различными методами, например, по его цвету, форме или растворимости в определенных реагентах.
В процессе качественного анализа осадочных реакций используется ряд реагентов, которые помогают идентифицировать тот или иной ион в растворе. Например, для обнаружения хлоридных ионов используется реактив серебра, который образует белый осадок хлорида серебра. Для обнаружения сульфатных ионов используется реактив бария, который образует белый осадок сульфата бария.
Осадочные реакции в качественном анализе являются важным инструментом для идентификации ионов в растворах. Они позволяют определить наличие или отсутствие определенных ионов и провести качественное исследование химического состава вещества. Это особенно важно в таких областях как аналитическая химия, медицинская диагностика и экологический анализ.
Осадочные реакции в количественном анализе
В количественном анализе осадочные реакции используются для определения концентрации ионов различных веществ в растворе. Для этого необходимо провести реакцию между ионами анализируемого вещества и стандартным раствором соединения, с которым они образуют осадок. Образовавшийся осадок затем отделяется от раствора и подвергается анализу с целью определения его массы или объема.
Одним из примеров осадочной реакции, используемой в количественном анализе, является реакция между ионами серебра и хлоридами. При наличии хлоридных ионов в растворе, добавление раствора серебряного нитрата вызывает образование хлоридного осадка агени, который можно взвесить и определить его содержание в анализируемом образце.
Для проведения осадочных реакций в количественном анализе необходимо учитывать ряд факторов, влияющих на процесс образования осадка. Это могут быть pH раствора, температура, концентрация реагентов и присутствие других веществ, которые могут повлиять на реакцию.
Осадочные реакции широко применяются в аналитической химии, так как позволяют определить концентрацию ионов различных веществ с высокой точностью. Они часто используются при анализе питьевой воды, почвы, пищевых продуктов и других образцов для определения содержания вредных примесей или полезных элементов.
🎦 Видео
ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Как решать задачи с МАССОВОЙ ДОЛЕЙ | Массовая доля растворенного веществаСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Задачи на примеси. 1 часть. 9 класс.Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Растворы и осадки (видео 1)| Произведение Растворимости | ХимияСкачать