Химический элемент сера имеет свойство образовывать различные соединения, в том числе такие, которые обладают кислотными свойствами. Одним из таких соединений является сероводород (H2S), который является слабой кислотой.
Слабая кислотность H2S обусловлена его химическим строением и свойствами. Молекула сероводорода состоит из двух атомов водорода и одного атома серы. Кислотные свойства H2S проявляются в результате диссоциации молекулы на ионы водорода (H+) и сульфидные ионы (HS-). Отсутствие дополнительных элементов, способных усилить кислотность, делает H2S слабой кислотой.
Одной из причин слабой кислотности H2S является низкая константа диссоциации, которая определяет степень диссоциации кислоты в водном растворе. У H2S эта константа очень мала, что делает его слабой кислотой. Кроме того, влияние других соединений, находящихся в растворе, может ослабить кислотные свойства H2S.
Несмотря на свою слабую кислотность, H2S все же является реакционно активным веществом. Он может вступать в реакции с разными веществами, образуя соединения с катионами металлов или образуя соли. Кроме того, H2S обладает характерным запахом гнилой яйца, который его диссоциация в организме человека может вызывать отравление.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химический состав H2S и его свойства
Химический состав H2S придает ему ряд уникальных свойств. Во-первых, сероводород является ядовитым. Он может накапливаться в атмосфере и составлять опасность для жизни людей и животных. Высокие концентрации H2S могут вызывать серьезные отравления и даже смерть. В связи с этим, сероводород является предметом внимания при осуществлении контроля за загрязнением окружающей среды.
В отличие от многих других кислот, сероводород является слабой кислотой. Это значит, что H2S не диссоциирует полностью в растворе, а лишь частично. Этот факт обуславливается химическим равновесием между молекулами H2S и образовавшимися ионами. Однако, несмотря на слабость кислотности, сероводород все же обладает кислотными свойствами и способен реагировать с основаниями, образуя соли.
Сероводород также характеризуется рядом физических свойств. Например, при низких температурах (-60 градусов по Цельсию и ниже) он переходит в твердое состояние, образуя кристаллический гидросульфид серы (S8H2). При комнатной температуре и нормальном давлении H2S является газообразным веществом.
Короче говоря, химический состав H2S и его свойства делают его уникальным и важным соединением во многих областях, включая химическую, нефтегазовую и экологическую промышленность.
Состав и структура H2S
H2S (водородсульфид) представляет собой химическое соединение, состоящее из двух атомов водорода и одного атома серы. Молекулярная формула H2S указывает на то, что водородсульфид молекулярного типа с общей валентностью равной нулю. Водородсульфид имеет простую структуру, в которой два атома водорода связаны с атомом серы.
Структура молекулы H2S объясняется его электронной конфигурацией и геометрией. Атом серы имеет 6 электронов в своей валентной оболочке, а атомы водорода имеют по одному электрону в своей валентной оболочке. Молекула H2S образует ковалентную связь между атомом серы и каждым атомом водорода. В результате получается электронное облачность, которая придает молекуле H2S специфическую трехмерную форму.
Структура молекулы H2S подобна структуре воды (H2O), однако угол между валентными связями в H2S составляет около 92 градусов, в то время как в воде он составляет около 104.5 градусов. Это обусловлено большей электронной плотностью атома серы, которая смещает электронные облака в сторону серы, что приводит к уменьшению угла связи.
Суммарная масса молекулы H2S равна 34.08 атомных единиц (аму). Атом серы вносит основной вклад в массу молекулы, так как его атомная масса равна 32 аму, в то время как атом водорода имеет атомную массу равную примерно 1 аму. Отношение масс водорода и серы в молекуле H2S равно примерно 1:32.
Общая формула H2S указывает на то, что в одной молекуле содержится 2 атома водорода и 1 атом серы. Это соотношение атомов обеспечивает уникальные свойства и реактивность водородсульфида, а также определяет его роль во многих химических процессах и природных явлениях.
Физические свойства H2S
- Температура кипения: H2S кипит при температуре -60 градусов Цельсия (-76 градусов по Фаренгейту) при нормальном атмосферном давлении. Это означает, что H2S находится в газообразном состоянии при комнатной температуре и давлении.
- Температура кристаллизации: H2S кристаллизуется при температуре -85 градусов Цельсия (-121 градус по Фаренгейту). Это означает, что при очень низких температурах H2S может превратиться в твердое состояние.
- Плотность: Плотность H2S в газообразном состоянии составляет около 1,54 г/литр. Это довольно легкий газ, который может подниматься в воздухе.
- Растворимость: H2S хорошо растворяется в воде, образуя сероводородную кислоту. При комнатной температуре и давлении, можно растворить около 3 граммов H2S в 1 литре воды.
- Летучесть: H2S является летучим веществом и испаряется при обычных условиях. Поэтому его можно обнаружить по запаху даже в небольших концентрациях в воздухе.
- Токсичность: H2S является ядовитым газом, который может быть опасен для человека при высоких концентрациях. Длительное вдыхание H2S может вызвать серьезные проблемы со здоровьем, включая отравление и даже смерть.
Эти физические свойства H2S играют важную роль в его использовании и обработке в различных сферах, таких как нефтегазовая промышленность, химическая промышленность и даже в медицине.
Кислотные свойства H2S
Кислотные свойства H2S обусловлены способностью этого соединения образовывать ион водорода H+ и сульфидный ион S2-. H2S реагирует с щелочами, в результате чего происходит образование солей. Вода, в которую погружен H2S, приобретает кислотные свойства и изменяет свой pH.
При реакции H2S с водой образуется гидросульфидная кислота HHS-
H2S + H2O ⇌ HHS- + H+
Это равновесие является реакцией обратимой, однако признаками кислотности H2S являются образование ионов H+ и увеличение концентрации H+ в растворе. Это объясняет кислотные свойства H2S.
| Свойства | Описание |
|---|---|
| Красные окраски | Растворы H2S с металлами образуют красные окраски, что связано с образованием солей металлов с низкими окисляющими свойствами. |
| Кислотное дыхание | H2S обладает резким запахом гнилых яиц и может вызывать кислотное дыхание при его вдыхании в высокой концентрации. При этом происходит реакция H2S с водой в организме, образуя сульфидные ионы, которые являются токсичными |
| Стабильность | В сильно кислых растворах, при pH ниже 4, H2S стабилен и не разлагается. Однако при повышении pH происходит диссоциация H2S и образование ионов. |
Таким образом, кислотные свойства H2S обусловлены его способностью образовывать ион водорода и проявлять кислотные реакции с веществами, такими как щелочи и металлы.
Видео:9.Сильные и слабые кислотыСкачать

Химическое равновесие и ионизация H2S
H2S, или сероводород, является слабой кислотой, что означает, что она ионизируется в воде только частично. Это происходит из-за особенностей химической структуры молекулы H2S.
Во время ионизации молекула H2S теряет один или оба атома водорода и образует ионы H+ и HS-. Более точно, ионизация H2S может быть представлена следующим уравнением:
H2S ⇌ H+ + HS-
Это уравнение показывает, что ионизация H2S происходит в обоих направлениях, вперед и назад, и что эта реакция находится в химическом равновесии. Это значит, что скорость обратной реакции равна скорости прямой реакции.
Степень ионизации H2S зависит от различных факторов, включая концентрацию H2S, температуру и наличие других веществ. Увеличение концентрации H2S или снижение температуры приведет к увеличению степени ионизации.
Константа равновесия, обозначенная как K, описывает степень диссоциации H2S и вычисляется как отношение концентраций продуктов и исходного вещества в химическом равновесии. Большая константа равновесия указывает на большую степень ионизации H2S.
Слабая кислотность H2S можно объяснить наличием сильной поляризации внутри молекулы. Атом серы частично отрицателен, в то время как атомы водорода частично положительны. Это приводит к образованию более слабого электростатического поля и более слабой ионизации.
В целом, понимание химического равновесия и ионизации H2S является важным для понимания его свойств и реакций, а также для использования его в различных промышленных и научных областях.
Реакция ионизации H2S в воде
Уравнение реакции ионизации выглядит следующим образом:
H2S + H2O → H+ + HS-
Эта реакция происходит в водном растворе H2S и является обратимой. Она осуществляется благодаря взаимодействию H2S с молекулами воды.
Реакция ионизации H2S в воде происходит в соответствии с принципом Лево-Лейбница, согласно которому слабые кислоты, такие как H2S, диссоциируют лишь частично. Это означает, что только небольшое количество H2S молекул распадается на ионы водорода и сульфидные ионы. В результате этой диссоциации в растворе образуется равновесное количество всех трех компонентов: H2S, H+, HS-.
Степень диссоциации H2S в воде определяется его константой равновесия, которая называется константой диссоциации сероводорода (Kd). Эта константа обратно пропорциональна степени диссоциации и показывает, насколько полная или неполная диссоциация H2S в воде. Так как H2S является слабой кислотой, его константа диссоциации Kd имеет невысокое значение.
Реакция ионизации H2S в воде играет значительную роль в различных химических и биологических процессах. Сероводород является существенным компонентом геотермальных источников, вулканических пещер и радоновых источников. Он также является важным продуктом аэробного и анаэробного разложения органических веществ в природе.
Реакция ионизации H2S в воде имеет множество промышленных и медицинских применений. Сероводород используется в процессе производства нефтепродуктов, водорода, серной кислоты и других химических соединений. Кроме того, сероводород используется в медицине как противомикробное средство и для лечения некоторых заболеваний.
Таким образом, реакция ионизации H2S в воде имеет важное значение как с точки зрения естественных процессов, так и в промышленности и медицине.
Равновесие диссоциации H2S
H2S ⇌ H^+ + HS^-
В данном уравнении H2S действует как слабая кислота, передавая протон H^+ и образуя ион HS^-. Обратная реакция также возможна, когда ион HS^- принимает протон и образует молекулу H2S.
Равновесие диссоциации H2S зависит от концентрации H2S и ионов H^+ в растворе, а также от температуры. При низких концентрациях H2S и низкой температуре, равновесие смещено влево, то есть обратная реакция преобладает. При повышении концентрации H2S и температуры, равновесие смещается вправо, и диссоциация H2S увеличивается.
Степень диссоциации H2S определяет, насколько большая часть молекул H2S распалась на ионы. Она может быть вычислена с помощью уравнения степени диссоциации:
Степень диссоциации = (концентрация ионов H^+ / начальная концентрация H2S) × 100%
Степень диссоциации H2S зависит от концентрации H2S и других факторов, таких как ионная сила раствора и наличие других химических веществ. Высокая ионная сила раствора и наличие других химических веществ могут снизить степень диссоциации H2S.
Равновесие диссоциации H2S играет важную роль в различных химических процессах, таких как гидросульфидные реакции и образование серы. Оно также влияет на кислотность растворов, в которых присутствует H2S.
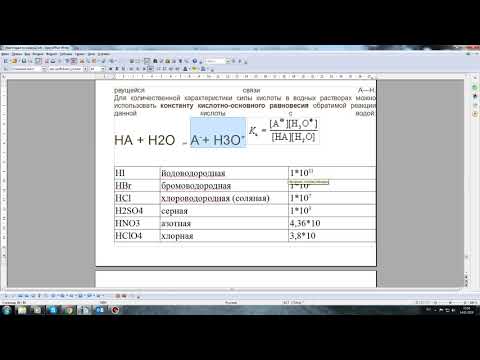
Константа равновесия и степень диссоциации H2S
Константа равновесия характеризует равновесное состояние реакции диссоциации H2S и показывает, насколько реакция идет в направлении образования H2S-ионов или наоборот, в направлении образования H+ и S2-ионов.
Записывается константа равновесия следующим образом:
K = [H+][S2-]/[H2S]
Константа равновесия зависит от температуры и давления. Если значение константы равновесия больше единицы, то считается, что реакция идет в направлении образования продуктов диссоциации (H+ и S2-ионов) и степень диссоциации H2S вещества высокая. Если значение константы равновесия меньше единицы, то реакция идет в направлении образования исходного вещества (H2S) и степень диссоциации низкая.
Степень диссоциации H2S показывает, какая часть молекул H2S распадается на ионы. Если степень диссоциации равна 1, то все молекулы H2S разлагаются на ионы при данной концентрации. Если степень диссоциации меньше 1, то только небольшая часть молекул H2S разлагается на ионы, остальные остаются в форме недиссоциированного H2S.
Степень диссоциации (α) связана со значением константы равновесия следующим выражением:
α = [H+]/[H2S]
Таким образом, константа равновесия и степень диссоциации H2S взаимосвязаны и описывают термодинамические характеристики химической реакции диссоциации H2S. Знание этих показателей позволяет более полно оценить кислотные свойства H2S и его поведение в различных средах.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Причины слабости кислотности H2S
Как и другие слабые кислоты, H2S диссоциирует в воде, выделяя молекулу воды и образуя ионы водорода (H+) и сульфида (S2-). Однако, по сравнению с сильными кислотами, диссоциация H2S происходит в меньшей степени.
Основной причиной слабости кислотности H2S является его молекулярная структура. Молекула H2S состоит из двух атомов водорода (H) и одного атома серы (S), соединенных связью с одной парой электронов. Эта связь является ковалентной, что означает, что электроны в ней делятся равномерно между атомами. Это создает слабое взаимодействие между H и S атомами, и молекула H2S оказывается слабо поляризованной.
Полярность молекулы влияет на способность кислоты отдавать протон и образовывать ион в воде. В случае H2S, слабая полярность молекулы ограничивает возможность эффективной диссоциации и образования ионов водорода, что приводит к слабости кислотности.
Кроме того, соль сильного основания и слабой кислоты, такие как NaHS, образует более стабильные ионы сульфида (HS-) и натрия (Na+) в растворе, что также свидетельствует о слабой кислотности H2S.
Таким образом, причины слабости кислотности H2S связаны с его молекулярной структурой и ограниченной способностью молекулы диссоциировать в воде, образуя ионы водорода. Это объясняет, почему H2S считается слабой кислотой.
💡 Видео
ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ПОЛНЫЙ РАЗБОР досрочного ЕГЭ по химии 2024 | Катя СтрогановаСкачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Ковалентная Полярная Связь — Химическая связь // Химия 8 классСкачать

Неорганика исключения: как запомнить сильные и слабые кислоты | Химия ЕГЭ | Лия Менделеева УМСКУЛСкачать

ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей. 9 класс.Скачать

ГЕНЕРАЛИЗОВАННОЕ тревожное расстройство (ГТР) | Признаки, симптомы, причины, лечение, самопомощьСкачать

Разбор всех типов 29-30 заданий из сборника Добротина 2023 | Екатерина СтрогановаСкачать

Сильные и слабые кислотыСкачать
Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Кислоты | Химия ЦТ, ЕГЭСкачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Определения кислоты и основания (видео 1) | Органические кислоты и основания | ХимияСкачать

Как отличить слабый электролит от сильного?Скачать

