Состояние газа определяется рядом важных параметров, которые являются ключевыми для понимания его свойств и поведения. Эти параметры включают давление, температуру и объем. Понимание взаимосвязи между этими параметрами является основой для изучения газовой теории и науки об идеальных газах.
Давление является одним из основных параметров, определяющих состояние газа. Оно характеризует силу, с которой газ молекулы сталкиваются с поверхностью сосуда, содержащего газ. Давление можно представить себе как силу, распределенную на единицу площади. Чем больше количество молекул, находящихся в данном объеме, и чем большую силу они оказывают на его стенки, тем выше будет давление.
Температура является еще одним важным параметром, определяющим состояние газа. Она характеризует среднюю кинетическую энергию молекул газа и определяет, насколько быстро они двигаются. Чем выше температура, тем выше кинетическая энергия частиц, и тем больше коллизий происходит между ними и со стенками сосуда. Следовательно, повышение температуры приводит к увеличению давления газа.
Объем также играет важную роль в определении состояния газа. Он отражает количество места, которое занимает газ в пространстве. Объем может изменяться в зависимости от давления и температуры газа: при увеличении давления объем уменьшается, а при увеличении температуры объем увеличивается. Это называется законом Бойля-Мариотта.
Таким образом, давление, температура и объем являются взаимосвязанными параметрами, определяющими состояние газа. Понимание и использование этих параметров позволяет углубить наши знания о поведении газов и применять их в различных областях, начиная от промышленных процессов и заканчивая анализом климата.
Видео:Урок 45 (осн). Давление газаСкачать

Определение состояния газа
Состояние газа определяется совокупностью его физических свойств, таких как давление, температура и объем. Каждый из этих параметров играет важную роль в характеристике и поведении газа.
Давление газа — это сила, которую молекулы газа оказывают на стенки сосуда или поверхность, с которой они взаимодействуют. Давление газа зависит от силы столкновений молекул и площади, на которую эти столкновения происходят.
Температура газа — это мера средней кинетической энергии молекул газа. Температура влияет на скорость движения молекул и их энергию столкновений. При повышении температуры, молекулы газа становятся более активными и быстро перемещаются.
Объем газа — это пространство, занимаемое газом. Объем газа может быть изменен путем сжатия или расширения. При сжатии, газ занимает меньший объем, а при расширении — больший.
Знание состояния газа позволяет нам предсказывать его поведение и реакцию на изменение внешних условий. Также это является основой для формулирования и применения законов, таких как закон Бойля-Мариотта и закон Шарля, которые описывают взаимосвязь между параметрами состояния газа.
Важно понимать, что состояние газа может изменяться в зависимости от изменения давления, температуры или объема. Эти изменения могут влиять на его свойства и общую характеристику. Поэтому, состояние газа является ключевым понятием в изучении физики и химии газовых систем.
Видео:Связь между давлением, объёмом и температурой газаСкачать

Давление газа
Согласно кинетической теории, давление газа возникает в результате хаотического движения молекул, которые сталкиваются друг с другом и со стенками сосуда. При каждой столкновении молекулы передают импульс и изменяют свое направление движения. Эти множественные столкновения создают давление, оказывающееся одинаковым во всех точках газовой среды.
Давление газа можно измерять в различных единицах, таких как паскали (Па), миллиметры ртутного столба (мм рт. ст.), атмосферы (атм) и др. Обычно для измерения давления используются специальные устройства, например барометры или манометры.
Важно отметить, что давление газа зависит от большого количества факторов, включая количество газовых молекул, их скорость, объем газовой среды и температура. Изменение любого из этих параметров может привести к изменению давления газа.
Понимание давления газа является важным для ряда областей, включая физику, химию, медицину и инженерию. Знание этого понятия позволяет решать различные задачи, связанные с передачей газов, регулированием давления и проектированием систем газоснабжения.
Определение давления
Величина давления обычно измеряется в паскалях (Па) или в других производных единицах, таких как атмосферы (атм), миллиметры ртутного столба (мм рт. ст.) или паунд-форса на квадратный дюйм (psi).
Определение давления связано с силой и площадью, на которую эта сила действует. Поэтому формула для определения давления выглядит следующим образом:
Давление (P) = Сила (F) / Площадь (A)
Таким образом, давление пропорционально силе и обратно пропорционально площади. Большая сила, действующая на меньшую площадь, приведет к большему давлению, в то время как меньшая сила, действующая на большую площадь, приведет к меньшему давлению.
Давление газа можно изменить путем изменения объема или температуры газа. По закону Бойля-Мариотта, при постоянной температуре, давление и объем газа обратно пропорциональны. По закону Шарля, при постоянном давлении, объем газа прямо пропорционален температуре.
Знание определения давления и его зависимости от объема и температуры газа позволяет более глубоко понять его свойства и использовать в различных областях науки и техники.
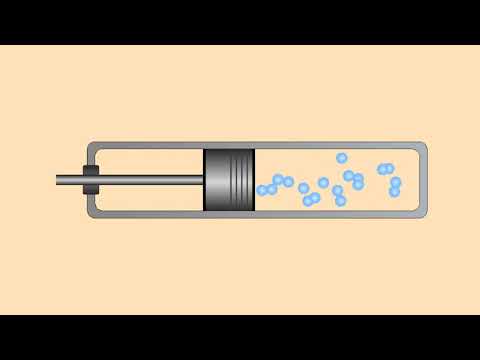
Закон Бойля-Мариотта
Закон Бойля-Мариотта, или просто закон Бойля, устанавливает зависимость между давлением и объемом газа при постоянной температуре. Суть закона заключается в том, что если при неизменной температуре количество газа постоянно, то его давление обратно пропорционально объему: чем больше объем газа, тем меньше его давление и наоборот.
Математическая формула закона Бойля-Мариотта выглядит следующим образом:
P1 * V1 = P2 * V2
где P1 и V1 — начальное давление и объем газа, а P2 и V2 — конечное давление и объем газа соответственно.
Этот закон был открыт и сформулирован в 17 веке Робертом Бойлем и Эдме Мариоттом. Он имеет большое практическое применение и используется во многих областях, таких как химия, физика, техника и медицина.
Закон Бойля-Мариотта объясняет такие явления, как работа поршневых двигателей, принцип действия компрессоров, работа турбин, а также задачи связанные с изменением объема газа в различных процессах.
Применение закона Бойля-Мариотта позволяет предсказывать изменение давления в газовых системах при изменении объема газа. Это также помогает оптимизировать работу систем, улучшить эффективность различных процессов и избежать аварийных ситуаций.
Видео:Давление газа | Физика 7 класс #27 | ИнфоурокСкачать

Температура газа
Определение температуры газа рассчитывается исходя из средней кинетической энергии молекул. Чем выше температура, тем больше средняя кинетическая энергия молекул, и, следовательно, быстрее и интенсивнее их движение.
Закон Шарля — один из основных законов, описывающих зависимость между температурой и объемом газа. Согласно этому закону, при постоянном давлении объем газа прямо пропорционален его температуре: если температура газа увеличивается, то и его объем также увеличивается.
Температура газа может быть измерена в различных шкалах, таких как Цельсий, Фаренгейт или Кельвин. Цельсий и Кельвин являются наиболее распространенными и широко используются в научных и инженерных расчетах.
Определение температуры газа играет важную роль во многих областях науки и техники, таких как физика, химия, метеорология, энергетика и многих других.
Определение температуры
Определение температуры газа производится путем сопоставления его состояния с эталонными значениями, которые определены при использовании стандартных средств измерений. Это могут быть термометры или другие приборы, основанные на физических законах.
Закон Шарля гласит, что при постоянном давлении объем газа прямо пропорционален его температуре. То есть, при повышении температуры газа, его объем увеличивается, а при понижении — уменьшается. Этот закон обусловлен линейной зависимостью между объемом и температурой газа.
Определение температуры газа может быть выполнено с использованием различных методов, включая использование термометров, термисторов, пирометров и других температурных сенсоров. Каждый из этих методов имеет свои особенности и применимость в различных ситуациях.
Температура газа играет важную роль в многих процессах и явлениях, таких как изменение объема, давление и свойства газовой среды. Она также влияет на химические реакции и физические свойства газовых смесей.
Таким образом, определение температуры газа является важным шагом при проведении исследований, анализе и контроле различных процессов, связанных с газовой средой.
Определение объема газа
Для определения объема газа часто используется простой эксперимент, при котором газ занимает известное пространство. Например, для газа, занимающего закрытый сосуд, его объем можно определить путем измерения объема сосуда до и после ввода или удаления газа. В результате разности этих двух значений можно получить объем газа.
Между объемом газа и другими параметрами состояния газа, такими как давление и температура, существуют законы, которые позволяют определить изменения объема в зависимости от этих параметров.
Один из основных законов, связанных с изменением объема газа, называется законом Шарля. Согласно данному закону, при постоянном давлении объем газа прямо пропорционален его температуре. Это означает, что если температура газа возрастает, то его объем также увеличивается, и наоборот.
Определение объема газа является важной задачей во многих научных и технических областях. Знание объема газа позволяет производить расчеты и прогнозировать его поведение в различных условиях, что в свою очередь имеет применение в разных сферах, включая химию, физику, метеорологию и технику.
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Объем газа
Определение объема газа основано на его свойстве расширяться и сжиматься в зависимости от изменения давления и температуры. Если газ сжимается, его объем уменьшается, а если газ расширяется, его объем увеличивается.
| Газ сжимается | Газ расширяется |
|---|---|
| Объем уменьшается | Объем увеличивается |
Для измерения объема газа можно использовать различные приборы, такие как шприцы, колбы с мерной шкалой или газовые счетчики. Объем газа может быть выражен в абсолютном или относительном значении, в зависимости от выбранной системы измерения.
Закон Шарля, также известный как закон изотермического расширения газа, показывает, что объем газа прямо пропорционален его температуре при постоянном давлении. Это значит, что при повышении температуры объем газа увеличивается, а при понижении температуры объем газа уменьшается.
Изучение объема газа позволяет понять его свойства и влияние на окружающую среду. Знание объема газа также имеет важное практическое значение, например, при расчете объема газа при его хранении или транспортировке.
Определение объема газа
Для определения объема газа существуют различные методы и инструменты. Один из самых простых способов измерения объема газа — использование градуированной емкости, такой как мерная пробирка или колба. Газ помещается в емкость, и затем с помощью шкалы на емкости определяется его объем. Этот метод особенно удобен для измерения объема малых количеств газа.
Другой способ измерения объема газа — использование газового флакона или баллона. Газ заполняет флакон или баллон, и затем объем газа определяется по меткам, нанесенным на флаконе или баллоне. Этот метод позволяет измерить объем газа как в жидкой, так и в газообразной форме.
Определение объема газа имеет важное значение во многих областях науки и техники. Например, при проектировании систем отопления и вентиляции необходимо знать объем газов, чтобы правильно рассчитать количество газовых аппаратов и их эффективность. В химической промышленности объем газа используется для определения концентрации реагентов, проведения химических реакций и контроля качества продукции.
📹 Видео
Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Физика 7 Давление газаСкачать

Зависимость давления газа от его температурыСкачать

Давление газаСкачать
Все формулы молекулярной физики, МКТ 10 класс, + преобразования и шпаргалкиСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Идеальный газ в молекулярно-кинетической теории | Физика 10 класс #28 | ИнфоурокСкачать

Физика 7 класс. § 37 Давление газаСкачать

Уравнение состояния идеального газа. 10 класс.Скачать

Физика 7 класс (Урок№19 - Природа давления газов и жидкостей. Закон Паскаля.)Скачать

идеальный газ | ДАВЛЕНИЕ ИДЕАЛЬНОГО ГАЗА | 10 класс МКТСкачать

Зависимость объёма газа данной массы от его температурыСкачать

Связь между давлением и объёмом газаСкачать

Урок 46 (осн). Передача давления жидкостями и газами. Закон ПаскаляСкачать

Давление газаСкачать

Насыщенный пар. Зависимость давления пара от температуры | Физика 10 класс #35 | ИнфоурокСкачать

