Ковалентная связь — это один из основных типов химической связи, которая возникает между атомами при обмене или общем использовании электронов. Особенностью ковалентной связи является равное или близкое значение электроотрицательностей связанных атомов, что приводит к равномерному распределению электронной плотности между ними.
Ковалентная связь образуется, когда два атома делят одну или несколько пар электронов, чтобы достичь наиболее стабильного состояния — октета, то есть иметь полный комплект внешних электронов (8 электронов для элементов главной группы). Это достигается общим использованием электронов обоими атомами.
Примерами ковалентной связи могут служить молекулы газовых элементов, таких как кислород (O₂), азот (N₂) и фтор (F₂). В этих молекулах оба атома образуют две ковалентные связи, чтобы обеспечить полный комплект внешних электронов. Ковалентная связь также встречается в молекулах органических соединений, включая молекулы углеводородов, кислоты и базы.
Ковалентная связь играет важную роль в химии, так как она обусловливает свойства и реактивность веществ. Она может быть одиночной, когда атомы делят одну пару электронов, двойной, когда делят две пары электронов, и тройной, когда делят три пары электронов. Различные типы ковалентных связей определяются числом общих электронных пар между атомами.
Видео:Ковалентная связь. 8 класс.Скачать
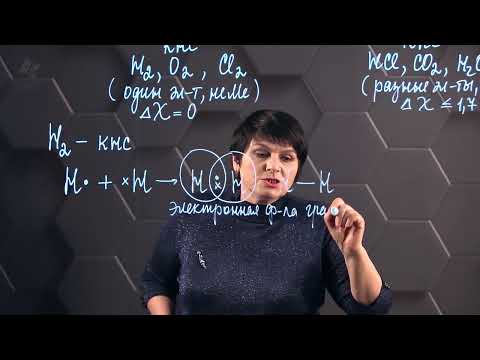
Особенности ковалентной связи
- Ковалентная связь характеризуется равномерным распределением электронной плотности между двумя атомами. В отличие от ионной связи, где электроны переходят полностью с одного атома на другой, при ковалентной связи электроны общие и находятся «между» атомами.
- Ковалентная связь возникает между неметаллами или между неметаллом и металлом. Неметаллы обычно имеют высокую электроотрицательность, что способствует образованию ковалентных связей.
- Если электроотрицательности двух атомов вещества примерно равны, то образуется неполярная ковалентная связь. В случае, когда электроотрицательности атомов различаются, образуется полярная ковалентная связь, где электроны проводимости наклонены к атому большей электроотрицательности.
- Сила ковалентной связи зависит от разницы электроотрицательностей атомов. Чем больше разница, тем слабее связь. Наиболее сильные ковалентные связи наблюдаются между атомами одного элемента (например, молекулы кислорода, где образуется двойная ковалентная связь).
- Ковалентная связь позволяет образовывать различные структуры молекул. В зависимости от количества общих электронных пар между атомами, могут образовываться одинарные, двойные и тройные ковалентные связи.
- Ковалентные связи обладают высокой энергией, что делает их устойчивыми. Это обуславливает стабильность молекул и их способность к существованию в различных условиях.
- Ковалентная связь играет важную роль в химических реакциях. При нарушении или образовании ковалентных связей происходят химические превращения, которые приводят к изменению свойств вещества и возникновению новых веществ.
В целом, ковалентная связь является основой для понимания структуры и свойств молекул, а также для объяснения химических реакций и взаимодействий между веществами.
Обмен электронами
Обмен электронами является основой образования ковалентных связей. Атомы, имеющие неполный электронный октет (набор электронов, подобный октету — внешней оболочке инертных газов), могут образовывать связи с другими атомами для достижения более стабильной конфигурации. Каждый атом старается достичь полной октетной конфигурации, обеспечивая себе более низкую энергию и большую стабильность.
В процессе обмена электронами один атом отдает свой электрон, становясь ионом положительного заряда (катионом), а другой атом принимает этот электрон, становясь ионом отрицательного заряда (анионом). При этом оба атома приобретают валентность и возможность образовать ковалентную связь с другими атомами.
Процесс обмена электронами может быть представлен следующим образом:
Атом 1 + Атом 2 → Атом 1+ + Атом 2— → Атом 1+ + Атом 2— + Связь
Таким образом, обмен электронами позволяет атомам образовывать ковалентные связи, удерживающие атомы вместе в молекуле. Эти связи играют важную роль в химических реакциях и определяют множество свойств химических соединений.
Образование молекул
Образование молекул может быть проиллюстрировано на примере образования молекулы воды из атомов водорода и кислорода. В этом случае, два атома водорода и один атом кислорода образуют ковалентные связи. Каждый атом водорода делит свой единственный внешний электрон с атомом кислорода, образуя пару электронов. Таким образом, образуется общая электронная оболочка у молекулы воды.
| Атомы | Ковалентные связи | Молекула |
|---|---|---|
| Водород | 2 | H2O |
| Кислород | 1 |
Таким образом, ковалентная связь позволяет атомам образовывать стабильные молекулы, в которых общий электронный облако создает прочную связь между атомами.
Сильная связь
Ковалентная связь отличается от других типов химических связей, таких как ионная или металлическая связь, своей силой и направленностью. Это обусловлено особенностями обмена электронами между атомами.
Ковалентная связь возникает между двумя атомами при совместном использовании электронов в их внешних оболочках. В результате обмена электронами образуется пара электронов, которая обращается между атомами в области их взаимодействия. Такая общая пара образует ковалентную связь.
Особенностью ковалентной связи является наличие направленности. Это означает, что связь формируется между определенными атомами, и электроны тесно связаны с этими атомами. Их движение предсказуемо и ограничено областью взаимодействия атомов.
Сильная связь, образуемая ковалентной связью, обеспечивает стабильность и прочность молекул и химических соединений. Ковалентные связи могут быть одинарными, двойными или тройными, в зависимости от количества общих электронных пар между атомами. Чем больше общих пар, тем сильнее и короче будет ковалентная связь.
Примеры сильной ковалентной связи включают связь водорода в молекуле воды и карбоновые связи в молекуле метана. В молекуле воды, кислород атом образует две ковалентные связи с двумя водородными атомами. В молекуле метана, углерод атом образует четыре ковалентные связи с четырьмя водородными атомами.
Также существует понятие двойной ковалентной связи, которую можно найти, например, в молекуле этилена. В этой молекуле, два углеродных атома образуют две ковалентные связи между собой, обеспечивая таким образом стабильность и структуру молекулы.
Видео:Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Примеры ковалентной связи
1. Связь водорода в молекуле воды:
- Молекула воды (H2O) состоит из двух атомов водорода и одного атома кислорода.
- Каждый атом водорода обладает одним электроном в валентной оболочке, а атом кислорода имеет восемь электронов.
- Для образования стабильной молекулы воды, атом кислорода делится своими электронами с атомами водорода.
- В результате обмена электронами, между атомами образуется ковалентная связь, которая обеспечивает структурную и химическую стабильность молекулы воды.
2. Карбоновые связи в молекуле метана:
- Молекула метана (CH4) состоит из одного атома углерода и четырех атомов водорода.
- Углерод имеет четыре электрона в валентной оболочке, а каждый атом водорода обладает одним электроном.
- Для достижения полной октетности валентной оболочки, атом углерода обменивается электронами с атомами водорода.
- Таким образом, между углеродом и каждым из атомов водорода образуются карбоновые связи, которые обеспечивают структурную стабильность молекулы метана.
3. Двойная ковалентная связь в молекуле этилена:
- Молекула этилена (C2H4) состоит из двух атомов углерода и четырех атомов водорода.
- Каждый атом углерода имеет четыре электрона в валентной оболочке, а каждый атом водорода обладает одним электроном.
- Для образования молекулы этилена, два атома углерода обмениваются по два электрона с атомами водорода.
- Это приводит к образованию двойной ковалентной связи между атомами углерода, которая обеспечивает структурную и химическую стабильность молекулы этилена.
Таким образом, ковалентная связь приводит к образованию стабильных молекул и является важным фактором в химических реакциях и свойствах веществ.
Связь водорода в молекуле воды
Эта связь имеет уникальные свойства, которые отличают ее от обычной ковалентной связи. Водородная связь является сильной, но в то же время межатомной расстояние вдвое больше, чем в обычной ковалентной связи. Она также характеризуется высокой полярностью и направленностью, что обусловлено неравным распределением электронной оболочки атомов азота, кислорода и водорода.
Водородная связь является одной из сильнейших межмолекулярных связей и играет важную роль во многих биологических и химических процессах. Она является основной причиной специфических физических и химических свойств воды, таких как повышенная кипучесть, высокая теплопроводность и теплоемкость, а также уникальные свойства льда.
В молекуле воды каждый атом водорода связан с двумя атомами кислорода, образуя угол приблизительно в 104,5 градусов. Это обусловлено электронной плотностью атома кислорода, которая смещена в сторону электронного облака, образующего связь, что приводит к образованию диполя.
Водородная связь в молекуле воды обладает большой энергией и обеспечивает прочность и стабильность структуры жидкой и твердой фаз воды. Благодаря своим уникальным свойствам, водородная связь играет важную роль в биологических процессах, таких как формирование и устойчивость протеинов, нуклеиновых кислот и многих других биологически активных молекул.
Карбоновые связи в молекуле метана
В молекуле метана каждый атом углерода образует четыре ковалентные связи с атомами водорода. Ковалентная связь основана на обмене электронами между атомами. В этом случае, каждый атом углерода делится своим электронным облаком с одним атомом водорода, что обеспечивает устойчивость молекулы.
Карбоновые связи в молекуле метана являются сильными и стабильными. Они обуславливают устойчивость молекулы и определяют ее химические и физические свойства. Благодаря этим связям метан является горючим газом.
Стоит отметить, что карбоновые связи в молекуле метана представляют пример одинарной ковалентной связи. В этом типе связи, атомы делят пару электронов между собой, что обеспечивает устойчивое электронное облако и образует молекулу.
Молекула метана имеет форму тетраэдра, где атомы водорода равномерно распределены вокруг атома углерода. Одна карбоновая связь направлена вверх, а остальные три — вниз. Это обусловлено геометрией молекулы и пространственным расположением атомов.
Карбоновые связи в молекуле метана являются ключевыми для понимания химических реакций, в которых участвуют углеводороды. Они определяют ее химическую активность и позволяют проводить множество химических превращений. Молекула метана служит основой для синтеза других углеводородов и химических соединений.
Двойная ковалентная связь в молекуле этилена
Образование двойной ковалентной связи происходит, когда два атома углерода совместно делят четыре электрона. Эти электроны образуют две связи между атомами углерода и одну связь между атомом углерода и атомом водорода. Таким образом, образуется структура, в которой два атома углерода связаны двумя связями, а атом углерода и атом водорода — одной связью.
Двойная ковалентная связь в молекуле этилена имеет очень важное значение. Она придает молекуле этилена особые свойства. Например, в молекуле этилена образуется плоская структура, которая обусловливает особые реакции и свойства этого соединения.
Двойная ковалентная связь в молекуле этилена также обеспечивает стабильность молекулы. Благодаря сильному сцеплению между атомами, молекула этилена становится устойчивой и не рассыпается на отдельные атомы.
Важно отметить, что двойная ковалентная связь в молекуле этилена является только одним из примеров связей, которые могут образовываться между атомами в химических соединениях. Другие примеры включают связь водорода в молекуле воды и карбоновые связи в молекуле метана. Каждая связь имеет свои уникальные характеристики и свойства, которые определяют поведение соединений.
💥 Видео
Ковалентная Неполярная Связь — Химическая связь // Химия 8 классСкачать

Ионная, ковалентная и металлическая связи | Типы химической связиСкачать

Ионная, ковалентная и металлическая связи | Химия. ВведениеСкачать

Химия 8 класс (Урок№30 - Ковалентная химическая связь. Полярная и неполярная ковалентная связь.)Скачать

Ковалентная Полярная Связь — Химическая связь // Химия 8 классСкачать

Химическая связь. Ковалентная связь | Химия ЕГЭ, ЦТСкачать

Ковалентная связь. 1 часть. 10 класс.Скачать

Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

8 класс.Химическая связь.Скачать

8. Виды химической связи.Скачать

Определяем тип химической связиСкачать

57. Механизмы образования ковалентной связиСкачать

Ионная, ковалентная и металлическая связиСкачать

Химия. Химическая связь. Ковалентная связь и ее характеристики. Центр онлайн-обучения «Фоксфорд»Скачать

56. Типы химических связей. Ковалентная связьСкачать

Ковалентная химическая связь | Химия 11 класс #4 | ИнфоурокСкачать

Химические связи: как их понять без заучивания и для чего это нужно? | Химия ЕГЭ 2022 | УмскулСкачать

Виды химической связи: ионная, ковалентная полярная и неполярная, донорно-акцепторная.Скачать

