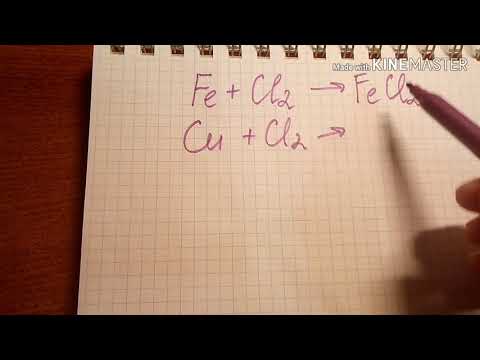Галогены – это одна из групп химических элементов, включающая фтор, хлор, бром, йод и астат. Они относятся к группе неметаллов и обладают высокой электроотрицательностью и реактивностью. Однако, характеристика свойств галогенов не настолько однозначна и проста, ведь у них можно наблюдать и некоторые металлические свойства.
Металлические свойства галогенов:
Несмотря на то, что галогены в целом относятся к неметаллам, они все же проявляют некоторые металлические свойства. Особенно это заметно в случае их взаимодействия с металлами. Например, галогены обладают способностью образовывать ионы, которые взаимодействуют с электронами металла, образуя ионогряды.
Кроме того, галогены могут проявлять подобие металлической проводимости, хотя и в очень ограниченных условиях. При очень высоких температурах и высоком давлении в парах галогенов наблюдается проводимость электрического тока, что может быть интересным для некоторых технических применений.
Неметаллические свойства галогенов:
Основные свойства галогенов все же неметаллические. Главной особенностью галогенов является их высокая электроотрицательность, что определяет их активность при химических реакциях. Галогены образуют многочисленные связи с другими элементами, в основном с металлами, обладающими электронно-отрицательными свойствами.
Кроме того, галогены обладают высокой реактивностью, особенно фтор, который считается самым активным химическим элементом. Их способность образовывать положительно заряженные ионы при взаимодействии с металлами и электроотрицательные свойства делают их важными компонентами в различных процессах, включая синтез органических соединений, производство лекарств и многое другое.
- Металлические и неметаллические свойства галогенов: особенности проявления
- Металлические свойства галогенов:
- Неметаллические свойства галогенов:
- Металлические свойства галогенов
- Высокая электроотрицательность
- Образование ионов при реакциях
- Неметаллические свойства галогенов
- Неметаллические свойства галогенов
- Кислотное поведение галогенов в реакциях
- Особенности проявления свойств галогенов
- Высокая степень окисления
- 🎥 Видео
Видео:Таблица Менделеева. Металлические и неметаллические свойства. Радиус атома.Скачать

Металлические и неметаллические свойства галогенов: особенности проявления
Металлические свойства галогенов:
- Высокая электроотрицательность
- Образование ионов при реакциях
Галогены, включая фтор (F), хлор (Cl), бром (Br) и иод (I), обладают высокой электроотрицательностью, что делает их сильными окислителями. Это означает, что они легко принимают электроны от других элементов и образуют отрицательно заряженные ионы.
При реакциях галогены образуют ионы, например ионы хлора (Cl-) или ионы иода (I-). Эти ионы имеют негативный заряд и являются основными активными формами галогенов в химических реакциях.
Неметаллические свойства галогенов:
- Высокая реакционность с металлами
- Кислотное поведение в реакциях
Галогены проявляют высокую реакционность при взаимодействии с металлами. Они способны образовывать с ними соли, например хлориды или бромиды. Это свойство может быть использовано в промышленности для получения различных веществ.
Галогены также проявляют кислотное поведение при взаимодействии с щелочными растворами или щелочными металлами. Они образуют кислотные соли, например хлориды или бромиды, которые растворяются в воде и образуют кислые растворы.
Таким образом, галогены проявляют и металлические, и неметаллические свойства, что делает их уникальными элементами. Изучение этих свойств позволяет лучше понять химические реакции и применение галогенов в различных областях науки и технологии.
Видео:Галогены. 9 класс.Скачать

Металлические свойства галогенов
Галогены относятся к группе элементов, которые характеризуются преимущественно неметаллическими свойствами. Однако, у некоторых из них можно наблюдать некоторые признаки металлического поведения.
Основным признаком металлических свойств галогенов является высокая электроотрицательность. Это свойство позволяет галогенам легко присоединяться к атомам других элементов, образуя с ними ионы. Ионы галогенов имеют отрицательный заряд и могут образовывать соли с положительно заряженными металлами.
Кроме того, галогены проявляют высокую реакционность с металлами, что также является свойством металлов. При взаимодействии с металлом, галогены могут вытеснить из его соединения более тяжелый галоген. Например, хлор может вытеснить из соединения йод, если условия реакции позволяют ему это сделать.
Однако, галогены также проявляют неметаллические свойства, такие как кислотное поведение в реакциях. Они могут образовывать кислоты или их производные. Взаимодействуя с металлами, галогены могут образовывать соли, которые являются ионными соединениями с характерным металлическим блеском.
Таким образом, металлические свойства галогенов проявляются в их высокой электроотрицательности, способности образовывать ионы при реакциях, высокой реакционности с металлами и кислотным поведением.
Высокая электроотрицательность
Высокая электроотрицательность галогенов делает их очень реактивными в химических процессах. Они обладают способностью притягивать электроны от других элементов. Галогены легко образуют химические связи с металлами, образуя ионные соединения, а также образуют ковалентные связи с другими неметаллами.
Высокая электроотрицательность галогенов также определяет их способность к окислению. Галогены часто выступают в качестве окислителей, т.е. они способны отбирать электроны у других веществ. Например, хлор может окислять водород до воды, получая при этом хлороводород.
Электроотрицательность галогенов также оказывает влияние на их физические свойства. Галогены обладают низкой температурой кипения и плавления по сравнению с другими элементами, что связано с сильными взаимодействиями между их молекулами и присутствием взаимодействий диполь-диполь.
Итак, высокая электроотрицательность галогенов является одной из основных характеристик этих элементов. Она определяет их химическую реакционность, способность образовывать химические связи с различными элементами, а также их физические свойства.
Образование ионов при реакциях
Галогены обладают высокой электроотрицательностью, что позволяет им легко отрывать электроны от атома и образовывать отрицательно заряженные ионы, так называемые галогенид-ионы. Например, фтор образует фторид-ионы (F-), хлор образует хлорид-ионы (Cl-), бром образует бромид-ионы (Br-) и иод образует иодид-ионы (I-).
При контакте галогенов с металлами происходит образование солей. Галогенид-ионы соединяются с положительно заряженными металлическими ионами, образуя ионные соединения. Например, хлор реагирует с натрием, образуя хлорид натрия (NaCl), а бром реагирует с калием, образуя бромид калия (KBr).
Кроме того, галогены могут проявлять кислотное поведение в реакциях. Они способны отстаивать протоны (H+) и образовывать кислотные соединения. Например, смесь хлора и воды образует хлороводородную кислоту (HCl), которая является одной из сильнейших кислот.
Таким образом, галогены проявляют свои неметаллические свойства, образуя ионы при реакциях с другими веществами. Это свойство является одной из особенностей химической активности галогенов.
Видео:ГАЛОГЕНЫ | Химия 9 классСкачать

Неметаллические свойства галогенов
Галогены, такие как фтор (F), хлор (Cl), бром (Br) и йод (I), проявляют ряд неметаллических свойств, которые делают их уникальными в химических реакциях.
Во-первых, галогены обладают высокой реакционностью с металлами. Они образуют с ними соли, которые обычно имеют белый цвет и хорошо растворяются в воде. Кроме того, галогенные соединения могут использоваться в качестве окислителей в химических процессах.
Во-вторых, галогены проявляют кислотное поведение в реакциях, особенно фтор и хлор. Они могут реагировать с щелочными металлами, образуя соли и выделяя газы, такие как водород и газы галогенов. Такие реакции широко используются в химической промышленности.
Галогены также проявляют высокую степень окисления. Это означает, что они могут принимать на себя большое количество электронов или электронных пар, что делает их мощными окислителями. Это свойство используется, например, при обработке воды для очистки от бактерий и микроорганизмов.
| Галоген | Атомный номер | Относительная атомная масса | Фаза при комнатной температуре |
|---|---|---|---|
| Фтор (F) | 9 | 18.998 | Газ |
| Хлор (Cl) | 1 | 35.453 | Газ |
| Бром (Br) | 2 | 79.904 | Жидкость |
| Йод (I) | 3 | 126.904 | Твердое вещество |
Таким образом, неметаллические свойства галогенов делают их важными элементами в различных сферах, таких как промышленность, медицина и научные исследования.
Неметаллические свойства галогенов
Галогены образуют с металлами соли, которые обладают различными свойствами. Например, бинарные соединения галогена с серебром (Ag) образуются сильно выраженными химическими реакциями, образуя хлорид серебра (AgCl), бромид серебра (AgBr) и йодид серебра (AgI).
Эти соли обладают различной растворимостью в воде. Например, хлорид серебра практически не растворим в воде, тогда как бромид серебра и йодид серебра растворяются в воде, образуя характерные цветные растворы.
Галогены также обладают кислотным поведением в реакциях. Они образуют кислотные оксиды, такие как диоксид хлора (ClO2) и тетраоксид хлора (ClO4), которые могут реагировать с основаниями и образовывать соли.
Галогены проявляют высокую степень окисления в соединениях. Например, фтор имеет степень окисления -1, а при взаимодействии с металлом может иметь степень окисления +1.
В целом, неметаллические свойства галогенов их делают важными элементами в химической промышленности и различных научных исследованиях.
Кислотное поведение галогенов в реакциях
Галогены, включая фтор (F), хлор (Cl), бром (Br) и йод (I), проявляют выраженное кислотное поведение в химических реакциях. Они образуют кислоты и оксокислоты, обладающие характерными свойствами.
Кислотные свойства галогенов проявляются в том, что они способны образовывать кислоты при соединении с водой или водными растворами. При этом образуются галогеноводородные кислоты, такие как фтороводородная (HF), хлороводородная (HCl), бромоводородная (HBr) и йодоводородная (HI) кислоты. Эти кислоты хорошо растворяются в воде и обладают выраженными кислотными свойствами.
Кислотное поведение галогенов также проявляется в их способности образовывать оксокислоты. Оксокислоты галогенов представляют собой кислородсодержащие соединения, содержащие атомы галогена и кислорода. Примером такой оксокислоты является хлорноватистая кислота (HClO), которая образуется при растворении хлора (Cl2) в воде. Эта кислота имеет мощные окислительные свойства и используется в промышленности и лабораториях.
Кислотное поведение галогенов в реакциях обусловлено высокой электроотрицательностью этих элементов. Это свойство позволяет галогенам эффективно привлекать электроны и образовывать стабильные отрицательно заряженные ионы. Именно благодаря этим ионам проявляется кислотный характер галогенов в реакциях.
Видео:9 класс. Галогены. Химические свойства.Скачать
Особенности проявления свойств галогенов
- Высокая электроотрицательность: Галогены обладают высокой электроотрицательностью, что делает их сильными окислителями. Они способны привлекать электроны других элементов и образовывать ионы с отрицательным зарядом.
- Образование ионов при реакциях: Галогены легко образуют ионы с отрицательным зарядом путем принятия одного электрона. Эти ионы, известные как галогенид-ионы, обычно образуют кристаллические структуры с ионами металлов или других положительно заряженных частиц.
- Высокая реакционность с металлами: Галогены обладают высокой реакционностью с металлами. Они могут замещать металлы в солевых соединениях и образовывать новые соединения галогенидов.
- Кислотное поведение в реакциях: Галогены образуют кислоты при реакции с основаниями. Эти кислоты имеют формулу HX, где X представляет галоген. Например, фтор реагирует с щелочью и образует фторид водорода (HF).
- Высокая степень окисления: Галогены имеют высокую степень окисления в химических соединениях. Например, фтор имеет степень окисления -1 в своих соединениях, а хлор -1 или +7.
Эти особенности проявления свойств галогенов являются ключевыми для понимания их роли в химических реакциях. Они способствуют образованию различных соединений и определяют их химические и физические свойства.
Высокая степень окисления
Высокая степень окисления галогенов обусловлена их высокой электроотрицательностью – способностью притягивать электроны к себе. При реакциях галогены образуют ионы с отрицательным зарядом, принимая один электрон от другого элемента. Таким образом, они становятся стабильными и обладают полным электронным октетом.
Высокая степень окисления галогенов также связана с их кислотным поведением в реакциях. Галогены могут образовывать кислоты с различными основаниями и их соли. При этом галогены действуют как окислители, передавая электроны другому веществу.
Проявление высокой степени окисления галогенов является важным свойством при проведении множества химических реакций. Например, галогены характеризуются высокой реакционностью с металлами, что позволяет использовать их в качестве окислителей при получении различных соединений.
| Галоген | Степень окисления |
|---|---|
| Фтор | -1 |
| Хлор | -1 |
| Бром | -1 |
| Иод | -1 |
🎥 Видео
ХИМИЯ 8 класс: Металлические и неметаллические свойства элементовСкачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать

Галогены. Видеоурок 22. Химия 9 класс.Скачать

ЕГЭ по химии. Вопрос 2: металлические свойстваСкачать

Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Галогены. Свойства. 2 часть. 10 класс.Скачать

Галогены.Элементы VII А группы.Скачать

Галогены. Химические свойства | ХимияСкачать

ГалогеныСкачать

Химические свойства металлов. 9 класс.Скачать

Галогены VIIA группа | Химия ЕГЭ, ЦТСкачать

Химические свойства соединений галогенов. Видеоурок по химии 9 классСкачать

Характеристика галогенов. Химия 9 классСкачать

Характеристика неметаллов. Видеоурок 8. Химия 9 классСкачать

Галогены (F, Cl, Br, I). Химические свойстваСкачать