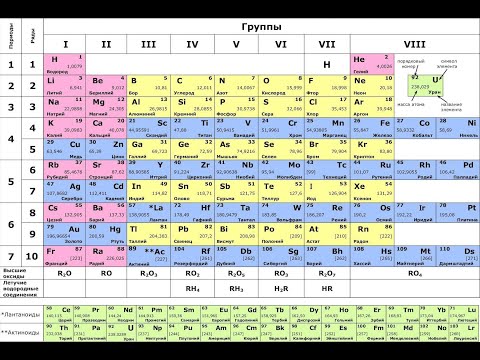
Таблица Менделеева — это удивительный инструмент, позволяющий организовать и классифицировать все известные элементы, которые составляют нашу вселенную. Каждый элемент обладает уникальными атомными и молекулярными свойствами, и одним из наиболее заметных отличий между ними является их цвет.
Цвет элементов в таблице Менделеева зависит от электромагнитного спектра световых волн, которые поглощают или отражают атомы или молекулы при взаимодействии с электромагнитным излучением. Каждый элемент имеет свой спектр поглощения и отражения, что определяет его цветовые свойства.
Свет — это электромагнитное излучение, имеющее определенную длину волны. Когда свет падает на атомы или молекулы элемента, оно может быть поглощено или отражено. Если свет поглощается, это означает, что энергия света передается атому или молекуле, что может вызвать переход электрона на более высокий энергетический уровень. Этот процесс часто сопровождается поглощением света определенной длины волны, что обусловливает цвет элемента.
Когда свет отражается от атомов или молекул элемента, это означает, что энергия света отразилась от поверхности без поглощения. При этом важно отметить, что некоторые элементы обладают определенными собственными цветами, которые связаны с их электронной структурой, внутренним положением в таблице Менделеева и другими факторами.
- Значение цвета элементов в таблице Менделеева
- Молекулярные свойства
- 4. Электронное строение
- Размер атома
- Электроотрицательность элементов в таблице Менделеева
- Атомные свойства элементов в таблице Менделеева
- Кристаллическая структура элементов в таблице Менделеева
- Уровень заполнения энергетических уровней
- 🔥 Видео
Видео:Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]Скачать
![Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]](https://i.ytimg.com/vi/N5xnKLO8j4Y/0.jpg)
Значение цвета элементов в таблице Менделеева
Цвет вещества определяется способностью атомов или молекул поглощать и испускать определенную длину волн света. Взаимодействие света с веществом происходит на уровне электронной строения. Когда свет проходит через вещество, его энергия возбуждает электроны в атомах или молекулах. При возврате электронов в исходное состояние они излучают фотоны с определенной энергией и длиной волны, которая определяет цвет вещества.
Цвет элементов в таблице Менделеева может быть разным из-за различной электронной структуры и уровня заполнения энергетических уровней. Некоторые элементы, такие как золото и серебро, обладают характерным желтоватым и серебристым цветом соответственно, из-за способности их атомов поглощать и отражать свет в определенном спектральном диапазоне.
Другие элементы, такие как кобальт (синий цвет) или хром (зеленый цвет), обладают цветностью из-за электронных переходов между энергетическими уровнями в их атомах. Эти переходы соответствуют поглощению и испусканию света определенной длины волны.
Цвет элементов имеет большое значение в различных областях таких, как химия, материаловедение, оптика и фотоника. Он может использоваться для идентификации элементов, а также для определения их состояния и структуры в различных веществах и материалах.
Важно отметить, что цвет элементов может изменяться в зависимости от состояния и окружения, а также от примесей или соединений, с которыми элементы взаимодействуют. Также цветность может быть изменена при изменении условий, таких как температура или давление.
Таким образом, значение цвета элементов в таблице Менделеева состоит в его использовании для определения их химических свойств, структуры и состояния. Цветность элементов является важным инструментом в научных исследованиях и промышленных приложениях, а также способом для визуализации и классификации химических веществ.
Видео:Таблица Менделеева. Металлические и неметаллические свойства. Радиус атома.Скачать

Молекулярные свойства
Молекулярные свойства элементов в таблице Менделеева зависят от их атомной структуры и взаимодействия атомов в молекуле. Эти свойства включают такие характеристики, как температура кипения и плавления, теплоемкость, вязкость, электропроводность и другие физические и химические свойства.
Молекулярные свойства элементов могут быть объяснены на основе их электронного строения. Атомы, состоящие из различного количества электронов, образуют разные типы связей и молекулярные структуры. Некоторые элементы, такие как кислород и азот, имеют высокую электроотрицательность и образуют межатомные связи с другими элементами, образуя стабильные молекулы.
Размер атома также влияет на его молекулярные свойства. Большие атомы могут образовывать более сильные связи, что приводит к более высоким точкам плавления и кипения.
Кристаллическая структура элемента также определяет его молекулярные свойства. Кристаллическая структура формируется при упорядоченном расположении атомов или молекул в кристалле и может влиять на его физические и химические свойства.
Уровень заполнения энергетических уровней также играет роль в молекулярных свойствах элементов. Энергетические уровни атомов определяют возможность образования связей и взаимодействия с другими элементами в молекуле.
Изучение молекулярных свойств элементов в таблице Менделеева позволяет понять их поведение в химических реакциях и использовать их в различных областях науки и технологии.
4. Электронное строение
Электроны в атоме распределены по энергетическим уровням и подуровням. Каждый энергетический уровень может вмещать определенное число электронов. Например, первый энергетический уровень может вмещать максимум 2 электрона, второй — 8 электронов, третий — 18 электронов и так далее.
Распределение электронов по энергетическим уровням определяет химические связи и реактивность элемента. Например, элементы с полностью заполненным последним энергетическим уровнем (например, благородные газы) обладают стабильной конфигурацией и не склонны образовывать химические связи. Наоборот, элементы с неполностью заполненными энергетическими уровнями стремятся завершить свою внешнюю оболочку, образуя связи с другими элементами.
Электронное строение также определяет электроотрицательность элемента. Электроотрицательность — способность атома притягивать электроны в химической связи. Чем больше электроотрицательность элемента, тем сильнее он притягивает электроны.
Важно отметить, что электронное строение не является единственным фактором, определяющим молекулярные и атомные свойства элементов. Есть и другие факторы, такие как размер атома и кристаллическая структура, которые также влияют на химические свойства элементов. Но электронное строение играет ключевую роль в определении химической активности и поведения элементов в химических реакциях.
Размер атома
Размер атома зависит от ряда факторов, включая номер элемента в таблице Менделеева, его электронную конфигурацию и валентную оболочку. Обычно размер атома увеличивается по мере увеличения атомного номера элемента в периоде. Это объясняется тем, что с увеличением номера элемента увеличивается количество электронов в атоме, а следовательно, увеличивается и его размер.
Значительное влияние на размер атома оказывает также его положение в таблице Менделеева. Например, атомы на левом конце периода обычно имеют больший размер, чем атомы на правом конце периода. Это связано с тем, что атомы на левом конце периода имеют меньшее количество электронов, что приводит к уменьшению электронных облаков и, следовательно, к уменьшению размера.
Размер атома также может меняться в зависимости от его окружающей среды и физических условий. Например, атомы в молекулярной форме могут иметь другой размер, чем атомы в элементарном состоянии. Это связано с эффектами взаимодействия атомов в молекуле и изменением расстояний между ними.
Размер атома — важная характеристика, которая оказывает влияние на многие свойства элементов. Он может определять способность атома образовывать химические связи, его реакционную способность, реакционную активность и другие физические и химические характеристики. Поэтому знание размеров атомов элементов в таблице Менделеева является необходимым для понимания и изучения их свойств и поведения.
В таблице ниже приведены значения атомных радиусов для некоторых элементов:
| Элемент | Атомный радиус (пм) |
|---|---|
| Водород | 37 |
| Углерод | 67 |
| Кислород | 48 |
| Фтор | 42 |
| Неон | 38 |
Электроотрицательность элементов в таблице Менделеева
Значение электроотрицательности для каждого элемента указано в таблице Менделеева и основано на различных эмпирических исследованиях. Электроотрицательность измеряется в безразмерных единицах, и чем выше ее значение, тем сильнее элемент притягивает электроны.
Электроотрицательность элемента влияет на его химические свойства и способность образовывать химические связи с другими элементами. Чаще всего элементы с более высокой электроотрицательностью образуют ионные связи, а элементы с меньшей электроотрицательностью образуют ковалентные связи.
В таблице Менделеева самая высокая электроотрицательность у флуора, равная 4.0, а самая низкая у франция, равная 0.7. Эти значения позволяют определять разницу электроотрицательности между элементами и использовать ее для прогнозирования типа химической связи и реактивности веществ.
Знание электроотрицательности элементов помогает химикам понять, как элементы сочетаются и взаимодействуют друг с другом в химических реакциях. Более электроотрицательный элемент будет тяготеть к привлечению электронов и при образовании связи получит небольшой отрицательный заряд, а менее электроотрицательный элемент получит положительный заряд.
Электроотрицательность является важным параметром в химической науке и играет ключевую роль в объяснении множества феноменов, таких как растворимости соединений, силы химических связей и электронной структуры молекул.
Важно отметить, что электроотрицательность элементов не является непрерывным параметром, и ее значение может варьироваться в зависимости от условий и окружающей среды.
Видео:68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Атомные свойства элементов в таблице Менделеева
Атомные свойства элементов в таблице Менделеева включают такие параметры, как кристаллическая структура и уровень заполнения энергетических уровней.
Кристаллическая структура является одним из важнейших атомных свойств элементов. Она определяется способом, которым атомы упорядочены в кристаллической решетке. Кристаллические структуры могут быть различными для разных элементов и могут варьироваться от простых до сложных. Кристаллическая структура влияет на многие свойства элементов, включая их механические, термические и электрические характеристики.
Уровень заполнения энергетических уровней также важен для определения атомных свойств элементов. Уровень заполнения энергетических уровней характеризует распределение электронов в атоме и определяет его химические свойства. Количество электронов внешней оболочки атома влияет на его реакционную способность и способность образовывать связи с другими атомами. Поэтому уровень заполнения энергетических уровней играет важную роль в понимании химических свойств и реакционной способности элементов.
Таким образом, атомные свойства элементов в таблице Менделеева, включая кристаллическую структуру и уровень заполнения энергетических уровней, являются ключевыми факторами, определяющими их химическое и физическое поведение.
Кристаллическая структура элементов в таблице Менделеева
Кристаллическая структура элементов может быть различной. Некоторые элементы имеют простую кубическую или гексагональную структуру, в то время как у других структура может быть более сложной, например, тройниковая, бесцентрированная кубическая или бесцентрированная гексагональная.
Кристаллическая структура элементов влияет на их физические и химические свойства. Например, благодаря своей кристаллической структуре, некоторые элементы обладают высокой прочностью и твердостью, такие как алмаз и кварц. Другие элементы могут быть хрупкими и ломкими из-за своей кристаллической структуры, например, серебро и свинец.
Изучение кристаллической структуры элементов помогает ученым понять их свойства и взаимодействие в различных химических реакциях. Это позволяет разрабатывать новые материалы с определенными свойствами, которые могут быть использованы в различных отраслях, таких как электроника, фармация, энергетика и многие другие.
Таким образом, кристаллическая структура элементов в таблице Менделеева играет значительную роль в определении их физических и химических свойств, и изучение этого аспекта является важным для понимания и применения химических элементов в различных областях науки и технологии.
Уровень заполнения энергетических уровней
Все электроны в атоме располагаются на энергетических уровнях, которые описываются квантовыми числами — главным квантовым числом (n), орбитальным квантовым числом (l), магнитным квантовым числом (m) и спиновым квантовым числом (s).
Уровни заполняются по принципу минимизации энергии, где каждый энергетический уровень может содержать определенное количество электронов. Всего существует 7 энергетических уровней, которые обозначаются числами от 1 до 7.
На первом энергетическом уровне (n=1) может находиться максимум 2 электрона. На втором уровне (n=2) максимум может быть 8 электронов, на третьем (n=3) — 18, на четвертом (n=4) — 32, на пятом (n=5) — 32, на шестом (n=6) — 18 и на седьмом (n=7) — 2.
Уровень заполнения энергетических уровней определяет электронную конфигурацию атома и его химические свойства. Число электронов на последнем заполненном энергетическом уровне определяет химическую активность элемента и его принадлежность к той или иной группе в таблице Менделеева.
Например, атомы с полностью заполненным энергетическим уровнем (2 электрона на первом уровне и 8 на втором) обладают стабильной конфигурацией и низкой химической активностью. Это элементы так называемых инертных газов — гелия, неона, аргона и др.
Атомы с неполностью заполненными энергетическими уровнями имеют высокую химическую активность и стремятся заполнить свободные энергетические уровни или освободиться от избыточных электронов путем образования химических связей.
Таким образом, уровень заполнения энергетических уровней играет ключевую роль в определении атомных свойств элементов, и от него зависит их поведение в химических реакциях и взаимодействиях с другими элементами.
🔥 Видео
Как определить металлы и неметаллы по таблице МенделееваСкачать

Как пользоваться таблицей Менделеева. Химия – простоСкачать

Есть ли конец у таблицы Менделеева?Скачать

СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать

5. Строение вещества. Атомы и молекулы (часть 1)Скачать

Относительная атомная масса химических элементов. 7 класс.Скачать

Лучшая модель атома? [Минутка физики]Скачать
![Лучшая модель атома? [Минутка физики]](https://i.ytimg.com/vi/eybcxXiYJfc/0.jpg)
Атомы и молекулы. Простые и сложные вещества. 7 класс.Скачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ХИМИКИ И ФИЗИКИ НАМ ВРУТ. ФАЛЬСИФИКАЦИЯ ТАБЛИЦЫ МЕНДЕЛЕЕВА. ПОЧЕМУ ИЗ ТАБЛИЦЫ ИЗЪЯЛИ ЭЛЕМЕНТ ЭФИРСкачать

Химия - просто. Урок 1 "ПСЭ"Скачать

Урок 11 (осн). Атомы и молекулыСкачать

Таблица Менделеева,как устроена? краткоСкачать

6. Периодическая система элементов. Таблица МенделееваСкачать
ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

