Газы – это одно из состояний вещества, которое отличается от твердого и жидкого свойством легко сжиматься. Это свойство газов вызывает интерес и вопросы у многих школьников и взрослых. Что делает газы такими податливыми? В чем состоит их способность быть сжатыми?
Ответ на этот вопрос связан с особенностями молекулярной структуры газа. Молекулы газов являются относительно свободными и движутся хаотически в трехмерном пространстве. Они не связаны друг с другом и находятся на достаточно большом расстоянии друг от друга.
Такое устройство молекулярной структуры газа позволяет ему быть сжатым. При повышении давления на газ, расстояние между молекулами уменьшается, однако их свободный хаотичный характер движения сохраняется. Молекулы газа не закреплены на месте и могут легко занимать новые положения в пространстве, приспосабливаясь к изменениям давления.
Видео:Давление газа | Физика 7 класс #27 | ИнфоурокСкачать

Молекулярная структура газов
Молекулы газов являются невидимыми и имеют очень малую массу по сравнению с массой самого газа. Они имеют определенную структуру и обладают энергией, которая определяет их движение.
Молекулы газа находятся в постоянном хаотическом движении, которое называется тепловым движением. Это движение обусловлено их кинетической энергией, которую они приобретают от окружающей среды.
Молекулы газа двигаются со скоростью, которая зависит от их массы и температуры газа. Чем больше масса молекулы и чем выше температура, тем быстрее они двигаются.
Молекулярная структура газов также определяет их свободный объем. Между молекулами нет постоянного контакта, и газы могут заполнять все имеющееся пространство без существенных взаимодействий.
В таблице ниже приведены основные характеристики молекулярной структуры газов:
| Свойство | Описание |
|---|---|
| Масса молекул | Очень малая по сравнению с массой газа |
| Движение молекул | Тепловое движение со случайным направлением |
| Скорость движения молекул | Зависит от массы и температуры газа |
| Свободный объем | Молекулы газа не взаимодействуют друг с другом |
Молекулярная структура газов является основой для объяснения множества свойств и законов, которые описывают поведение газов. Понимание этой структуры помогает уяснить, почему газы легко сжимаются и как они изменяют объем при изменении давления и температуры.
Движение молекул газа
Молекулы газа взаимодействуют друг с другом с помощью коллизий, то есть сталкиваются между собой и обмениваются энергией. Взаимодействие между молекулами и их движение определяют физические свойства газа, такие как давление, объем и температура.
Молекулы газа имеют большую скорость, по сравнению с молекулами жидкости или твердого тела. При этом, различные молекулы могут иметь разные скорости, среди которых есть быстрые и медленные молекулы. При увеличении температуры, средняя скорость молекул газа также увеличивается.
Движение молекул газа является основой для объяснения таких явлений, как диффузия, теплопроводность и давление газа. Коллизии между молекулами влекут за собой перераспределение энергии и движение молекул внутри газового объема.
Общая энергия молекул газа зависит от их скорости и массы. Молекулы с более высокой скоростью обладают большей энергией. Увеличение температуры также приводит к увеличению энергии молекул газа.
Таким образом, движение молекул газа является фундаментальным свойством газовой среды. Оно определяет поведение газа и его физические свойства. Понимание движения молекул газа позволяет объяснить множество явлений в физике и химии.
Свободный объем газовой среды
Свободный объем газовой среды может быть изменен изменением объема сосуда или изменением количества газа. Например, при увеличении объема сосуда при постоянной температуре, свободный объем газовой среды увеличивается, так как молекулы газа получают больше места для свободного движения. Обратно, при уменьшении объема сосуда, свободный объем газовой среды уменьшается, и молекулы газа сталкиваются друг с другом и с внутренними стенками сосуда чаще.
Кроме того, свободный объем газовой среды может быть изменен изменением количества газа путем добавления или удаления газа из сосуда. При добавлении газа, свободный объем увеличивается, и молекулы газа занимают больше места для свободного движения. При удалении газа, свободный объем уменьшается.
Свободный объем газовой среды имеет важное значение для понимания физических свойств газов и их поведения. Изменение свободного объема может привести к изменению давления газа, его плотности и других свойств. Поэтому, чтобы более полно понять газы и их свойства, необходимо учитывать свободный объем газовой среды.
Видео:Физика 7 Давление газаСкачать

Зависимость объема газа от давления и температуры
Один из этих законов – это закон Бойля-Мариотта, который устанавливает обратную пропорциональность между объемом газа и его давлением при неизменной температуре. Согласно этому закону, если температура газа остается постоянной, то при увеличении давления его объем уменьшается, а при уменьшении давления – увеличивается.
Второй закон – это закон Шарля, который устанавливает прямую пропорциональность между объемом газа и его температурой при неизменном давлении. Если давление газа не меняется, то его объем увеличивается при повышении температуры и уменьшается – при понижении.
Закон Бойля-Мариотта и закон Шарля объединены в одно общее уравнение состояния идеального газа – это уравнение Ван-дер-Ваальса. В этом уравнении учитываются не только давление и температура, но и объем молекул газа и их взаимодействие друг с другом.
Таким образом, зависимость объема газа от давления и температуры играет важную роль в физике газов и находит широкое применение в различных областях науки и техники, таких как химическая промышленность, авиации и метеорология.
Закон Бойля-Мариотта
Закон Бойля-Мариотта описывает зависимость между давлением и объемом газа при постоянной температуре. Он был открыт исследователями Робертом Бойлем и Эдми Мариоттом в 17 веке. Согласно этому закону, при постоянной температуре, объем газа обратно пропорционален давлению.
Формула закона Бойля-Мариотта выглядит следующим образом:
p1 * V1 = p2 * V2
где p1 и V1 — начальное давление и объем газа, p2 и V2 — конечное давление и объем газа соответственно.
Из этой формулы следует, что при увеличении давления на некоторое количество раз, объем газа уменьшается в такое же количество раз и наоборот.
Таким образом, закон Бойля-Мариотта позволяет оценить, как изменяется объем газа при изменении давления при постоянной температуре. Этот закон имеет большое значение в физике и применяется в различных областях, включая газовую химию, метрологию и инженерию.
Закон Шарля
Закон Шарля, или закон пропорциональности, установленный Жаком Шарлем при исследовании газовых смесей, гласит, что при постоянном давлении объем газа пропорционален изменению температуры.
Формула:
V₁ / T₁ = V₂ / T₂
Где V₁ и V₂ — объемы газа при начальной и конечной температуре соответственно, T₁ и T₂ — начальная и конечная температуры.
Закон Шарля позволяет предсказать, как изменится объем газа при изменении его температуры. Если температура газа повышается, то его объем увеличивается. Если температура газа понижается, то его объем уменьшается.
Пример:
При изначальной температуре газ имеет объем 1 литр. При температуре 0°C. Что будет с объемом газа, если его нагреть до 20°C?
Для решения данной задачи нужно использовать формулу закона Шарля:
V₁ / T₁ = V₂ / T₂
Заменяя значения искомой температуры и начальной температуры на градусы Кельвина (20+273 = 293 К, 0+273 = 273 К), мы получим:
1 / 273 = V₂ / 293
Отсюда находим V₂:
V₂ = 293 / 273 = 1,073 литра
Таким образом, при повышении температуры на 20°C объем газа увеличится на 0,073 литра.
Видео:Действие жидкости и газа на погруженное в них тело | Физика 7 класс #36 | ИнфоурокСкачать

Физические свойства газов
Газы, как состояние вещества, обладают определенными физическими свойствами, которые делают их уникальными и широко используемыми в нашей повседневной жизни.
Одним из основных свойств газов является подвижность. Газы могут заполнять любые имеющиеся в объеме пространства, распространяться и перемещаться с высокой скоростью. Их молекулы не соединены между собой и перемещаются во всех направлениях, сталкиваясь друг с другом и с предметами, которые встают на их пути.
Еще одним важным свойством газов является сжимаемость. Газы легко сжимаются под действием внешнего давления, что позволяет изменять их объем без изменения массы. При сжатии газов их молекулы сближаются и уменьшается межмолекулярное расстояние, что приводит к увеличению плотности газовой среды.
Еще одна важная характеристика газов — их плотность. Плотность газа определяется как масса газа, содержащегося в единице объема. В отличие от твердых и жидких веществ, газы имеют очень низкую плотность, что делает их легкими и способными заполнять большие объемы пространства.
Кроме того, газы обладают компрессибельностью, то есть способностью изменять свой объем при изменении давления. При увеличении давления на газ, его объем уменьшается, а при уменьшении давления — увеличивается. Такое свойство основано на упругом взаимодействии между молекулами газа и называется законом Бойля-Мариотта.
Таким образом, физические свойства газов делают их незаменимыми в множестве процессов и являются основой для понимания и изучения их поведения в различных условиях.
Плотность газов
Плотность газа может быть вычислена по формуле:
ρ = m/V
где:
- ρ — плотность газа;
- m — масса газа;
- V — объем газовой среды.
В отличие от твердых и жидких веществ, газы характеризуются очень низкой плотностью. Это объясняется тем, что между молекулами газа существуют большие промежутки, в результате чего масса газа значительно меньше, чем у твердых или жидких веществ при том же объеме.
Плотность газов также зависит от давления и температуры. При повышении давления или снижении температуры плотность газа увеличивается, так как молекулы газа сближаются друг с другом. Например, при сжатии газа под давлением его плотность возрастает, а объем уменьшается.
Плотность газа также может быть использована для определения его состава. Различные газы имеют разные плотности, поэтому путем измерения плотности можно определить, какие газы находятся в смеси. Это применяется, например, в химическом анализе газовых смесей.
Измерение плотности газа может быть осуществлено с помощью таких приборов, как гидростатический весы, плотномеры или пирометры. Для различных газов существуют таблицы с их плотностью при различных условиях.
Таким образом, плотность газов — это важное свойство, которое позволяет определить массу газа в определенном объеме и использовать его для различных научных и технических целей.
Компрессибельность газов
Закон компрессибельности газов формулируется следующим образом: с увеличением давления на газовую среду ее объем сокращается, а с уменьшением давления – увеличивается.
Это явление объясняется молекулярной структурой газов. Молекулы газов находятся в постоянном беспорядочном движении. Благодаря этому, при увеличении давления на газ, молекулы сближаются и занимают меньший объем.
Примером компрессибельности газов является заправка автомобильной шины. При подключении насоса для накачивания шины, давление воздуха внутри шины увеличивается, что приводит к сжатию объема газа. После удаления насоса и закрытия клапана, давление воздуха снижается, и объем газа в шине увеличивается.
Однако, не все газы обладают одинаковой компрессибельностью. Инертные газы, такие как гелий, имеют низкую компрессибельность, в то время как активные газы, например, кислород, обладают высокой компрессибельностью.
Знание компрессибельности газов позволяет прогнозировать и управлять их поведением, и имеет практическое применение в различных областях, включая газовую технику, химическую промышленность и метеорологию.
🔍 Видео
Давление газаСкачать
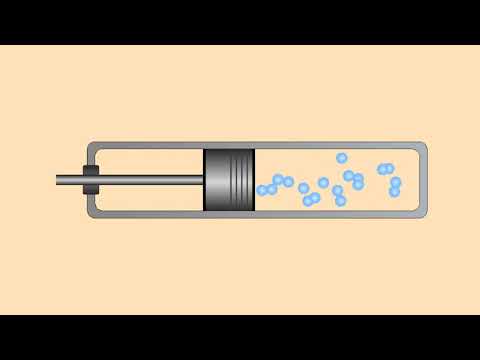
Опыты по физике. Сжимаемость газов и жидкостейСкачать

Давление в жидкостях и газах. Закон Паскаля. 7 класс.Скачать

Давление в жидкости и газе | Физика 7 класс #29 | ИнфоурокСкачать

Различия в молекулярном строении газов, жидкостей и твердых тел | Физика 7 класс #8 | ИнфоурокСкачать

Физика 7 класс. § 37 Давление газаСкачать

Физика 7 класс. §50 Действие жидкости и газа на прогружённое в них телоСкачать

Тепловое расширение твёрдых телСкачать

Передача давления жидкостями и газам. Закон Паскаля | Физика 7 класс #28 | ИнфоурокСкачать

Физика 7 класс (Урок№25 - Действие жидкости и газа на погружённое в них тело.)Скачать

Физика 7 класс (Урок№22 - Обобщение и решение задач по теме«Давление твердых тел,жидкостей и газов»)Скачать

Давление газаСкачать

Физика 7 класс. Давление в жидкости и газеСкачать

Физика 7 класс. §38 Передача давления жидкостями и газами. Закон ПаскаляСкачать

Физика 7 класс (Урок№19 - Природа давления газов и жидкостей. Закон Паскаля.)Скачать

Сжимаемость газов и жидкостей. ФизикаСкачать

