Химическое равновесие является одной из фундаментальных концепций в химии и играет важную роль в понимании реакций между веществами. Что же означает динамическое равновесие? В отличие от статического равновесия, при котором все явления и процессы полностью прекращаются, динамическое равновесие предполагает, что скорость прямой и обратной реакции становятся равными. Это означает, что хотя изменения могут происходить в системе, нет никакого видимого изменения общего состояния системы. Вместе с тем, динамическое равновесие не является статическим, так как своим характером оно всегда демонстрирует движение и изменение.
Один пример динамического равновесия в химии — это реакция образования воды. Реакция 2H2 + O2 ↔ 2H2O является обратимой и может двигаться в направлении образования водорода и кислорода или в направлении образования воды. В начальный момент времени, когда смесь содержит только водород и кислород, прямая реакция ведет к образованию воды, но по мере того, как продукты обратной реакции накапливаются, обратная реакция начинает преобладать, и скорость образования и распада воды становятся равными, достигая динамического равновесия.
Еще одним примером является реакция диссоциации кислот. Реакция H2O ↔ H+ + OH- демонстрирует динамическое равновесие между скоростью образования ионов водорода и гидроксида. Когда вода находится в контакте с кислотой, прямая реакция диссоциации преобладает, и вода превращается в ионы водорода и гидроксида. Однако, по мере накопления ионов, обратная реакция начинает преобладать, и динамическое равновесие устанавливается.
- Что такое химическое равновесие?
- Определение и основные понятия
- Примеры где наблюдается химическое равновесие
- Почему химическое равновесие — динамический процесс?
- Обратимость реакций
- Скорость прямой и обратной реакции в химическом равновесии
- Закон активности в химическом равновесии
- Зависимость и изменение химического равновесия
- 📺 Видео
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Что такое химическое равновесие?
- Определение и основные понятия
Для понимания химического равновесия необходимо знать несколько основных понятий. Реагенты — это вещества, которые участвуют в реакции, а продукты — это вещества, которые образуются в результате реакции. Степень протекания реакции определяется коэффициентами перед веществами в химическом уравнении.
- Примеры где наблюдается химическое равновесие
Химическое равновесие можно наблюдать во многих химических реакциях. Например, реакция образования воды из водорода и кислорода:
2H₂ + O₂ → 2H₂О
В начале реакции образуются молекулы воды, но со временем скорость образования и разложения воды становится равной, и концентрации веществ перестают меняться. Именно это и является химическим равновесием.
- Почему химическое равновесие — динамический процесс?
Химическое равновесие является динамическим процессом, потому что на уровне молекул реакция продолжается: молекулы продуктов распадаются на реагенты, а реагенты образуют новые молекулы продуктов. Однако, на макроскопическом уровне концентрации остаются постоянными, что вызывает впечатление, будто реакция не протекает.
- Обратимость реакций
- Скорость прямой и обратной реакции
- Закон активности
Обратимость реакций является основным условием возникновения химического равновесия. Реакция может протекать в прямом направлении от реагентов к продуктам и в обратном направлении от продуктов к реагентам. Скорость прямой и обратной реакций также становятся равными в состоянии равновесия.
Закон активности — это математическое выражение, которое описывает зависимость концентраций реагентов и продуктов от их активностей. Закон активности позволяет предсказывать изменение химического равновесия при изменении концентраций веществ или физических условиях.
Зависимость и изменение химического равновесия в основном определяются принципом Ле Шателье. Если на эту систему воздействует изменение в одном из параметров, таких как температура, давление или концентрация веществ, равновесие будет смещаться в ту сторону, которая компенсирует это изменение и восстанавливает равновесие.
Определение и основные понятия
Важными понятиями, связанными с химическим равновесием, являются реагенты и продукты. Реагенты — это вещества, участвующие в реакции и исчезающие при ее продолжении, а продукты — это новые вещества, образующиеся в результате реакции.
Коэффициенты перед формулами в реакционном уравнении показывают соотношение между реагентами и продуктами, а степенью их взаимодействия называется стехиометрический коэффициент. Он указывает на количество молекул или атомов, участвующих в реакции.
Константа равновесия — это величина, определяемая как отношение концентраций продуктов к концентрациям реагентов в равновесии. Ее значение позволяет оценивать степень протекания реакции и направление ее при обратимых реакциях. Константа равновесия обозначается символом K.
Термодинамическое равновесие — это равновесие, достигнуто в термодинамической системе, когда нет никаких предпочтительных направлений для ее эволюции. Это состояние является стабильным и устойчивым. Установление термодинамического равновесия требует достижение динамической равновесной системы.
Химическое равновесие, как динамический процесс, является ключевым понятием в химии. Оно играет важную роль в понимании и исследовании протекания химических реакций, а также в разработке различных технологических процессов и методов производства.
Примеры где наблюдается химическое равновесие
Один из примеров химического равновесия — это реакция между двумя газами, такими как азот и водород, где образуется аммиак:
N2 + 3H2 ⇌ 2NH3
В начале реакции в системе преобладает азот и водород, но по мере продолжения реакции концентрация аммиака увеличивается, а концентрации исходных реагентов уменьшаются. В конечном итоге, скорошенность прямой и обратной реакции становится равной, и система достигает химического равновесия.
Еще один пример химического равновесия — это реакция между двумя веществами разного цвета, такими как бромная вода и гидросульфит натрия:
Br2 + 2Na2S2O3 + H2O ⇌ 2NaBr + Na2SO4 + 2H2SO3
Исходная смесь имеет темно-коричневый цвет из-за бромной воды, но по мере продолжения реакции цвет меняется и становится безцветным. Когда скорости прямой и обратной реакций становятся равными, система достигает химического равновесия.
Все приведенные примеры демонстрируют, что химическое равновесие является динамическим процессом, в котором реакции происходят в обоих направлениях, и концентрации реагентов и продуктов остаются постоянными.
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Почему химическое равновесие — динамический процесс?
Однако, несмотря на внешнюю статичность, химическое равновесие на самом деле является динамическим процессом. Получение равновесия требует времени, и его нарушение может привести к изменению состава системы.
Одной из причин динамичности химического равновесия является обратимость реакций. В химической системе могут происходить как прямые реакции, так и обратные реакции, в результате которых и образуется равновесие.
Скорость прямой и обратной реакции также влияет на динамичность химического равновесия. Если скорость прямой реакции увеличивается, то система смещается в сторону образования продуктов. Аналогично, если скорость обратной реакции увеличивается, то система смещается в сторону исходных веществ.
Важную роль в динамике химического равновесия играет закон активности. Согласно этому закону, активность химических веществ в системе является реальной причиной смещения равновесия.
И наконец, зависимость и изменение химического равновесия также связаны с динамикой процесса. Равновесие может изменяться при изменении температуры, давления или концентраций веществ в системе. При этом равновесие будет смещаться в сторону увеличения числа молекул продуктов или исходных веществ, чтобы установить новое равновесие.
Таким образом, химическое равновесие, хотя и кажется статичным, на самом деле представляет собой сложный динамический процесс, который зависит от множества факторов и может подвергаться изменениям.
Обратимость реакций
Понятие обратимости реакций основано на законе действующих масс, который утверждает, что скорость реакции пропорциональна концентрации реагентов. Если реакция обратима, то и протекающая реакция и обратная реакция могут происходить одновременно.
Обратимость реакций связана с направлением, в котором было начато формирование продуктов реакции. Если реакция была начата с избытком одного из реагентов, то скорость обратной реакции будет выше, и наоборот. Это важно при планировании химического процесса и определении условий для достижения требуемых продуктов.
Также, обратимость реакций связана с равновесной постоянной, которая представляет соотношение концентраций реагентов и продуктов на химическое равновесие. Если равновесная константа больше единицы, это означает, что продукты реакции доминируют, в то время как если она меньше единицы, то реагенты доминируют.
Знание обратимости реакций является важным инструментом для контроля и оптимизации химических процессов, таких как синтез и разложение веществ. Понимание этого понятия помогает химикам эффективно использовать реагенты и улучшить выход продуктов реакции.
| Примеры реакций | Обратимость реакций |
|---|---|
| Образование воды из водорода и кислорода | Обратимая |
| Превращение фосфенолпирyваткиназы в пигментированную пирyваткиназу в эритроцитах | Необратимая |
| Разложение аммиака на азот и водород | Обратимая |
Скорость прямой и обратной реакции в химическом равновесии
В химическом равновесии скорости прямой и обратной реакций становятся равными. Это значит, что количество веществ, превращающихся в продукты реакции, становится равным количеству продуктов, обратно превращающихся в исходные вещества. Когда эти скорости становятся равными, реакция считается находящейся в равновесии.
Скорости химических реакций зависят от многих факторов, таких как температура, концентрации реагентов и катализаторов. В химическом равновесии эти факторы оказывают влияние как на скорость прямой реакции, так и на скорость обратной реакции.
Скорость прямой реакции в химическом равновесии определяется концентрацией исходных веществ. Если концентрация реагентов выше, скорость прямой реакции будет выше, и наоборот. Скорость обратной реакции зависит от концентрации продуктов. Чем выше концентрация продуктов, тем выше скорость обратной реакции.
Для достижения равновесия в химической реакции необходимо, чтобы скорость прямой и обратной реакций стали равными. Это может произойти при определенных условиях, например, при определенной температуре и концентрации реагентов. Если эти условия изменяются, равновесие может сдвинуться в сторону прямой или обратной реакции, чтобы компенсировать изменение.
Изменение скорости прямой и обратной реакций может привести к сдвигу равновесия в одну из сторон. Например, если увеличить концентрацию одного из реагентов, скорость прямой реакции возрастет, и равновесие сместится в сторону образования большего количества продуктов. Сдвиг равновесия в ту или иную сторону зависит от принципа Ле Шателье, который гласит, что система, находящаяся в равновесии, будет смещаться в направлении, противодействующему внешнему воздействию.
Скорости прямой и обратной реакций в химическом равновесии могут быть изменены при изменении температуры. При повышении температуры скорость прямой реакции может возрасти, тогда как скорость обратной реакции уменьшится. При понижении температуры происходит противоположный эффект. Это объясняется тем, что при повышении температуры частицы движутся быстрее, что приводит к увеличению силы столкновений между ними и, следовательно, увеличению скорости реакции. При понижении температуры частицы движутся медленнее, поэтому частота столкновений уменьшается, что приводит к снижению скорости реакции.
Закон активности в химическом равновесии
В химическом равновесии каждая вещество имеет свою активность, которая зависит от его концентрации, температуры, давления и других факторов. Закон активности позволяет выразить связь между этими параметрами.
В общем случае, закон активности может быть записан следующим образом:
K = γA · γB · …
где K — постоянная равновесия, представляющая собой произведение концентраций (или давлений) продуктов в степени их коэффициента в химическом уравнении, γA и γB — активности соответствующих веществ.
Активность может быть выражена как отношение между концентрацией (или давлением) и активностью стандартного состояния. Для идеального газа активность равна единице, поэтому закон активности упрощается до следующего вида:
K = [A]a · [B]b · …
где [A] и [B] — концентрации (или давления) соответствующих веществ, a и b — степени соответствующих соединений в химическом уравнении.
Закон активности позволяет определить, как изменение концентрации или других параметров влияет на равновесное состояние системы. Он также может быть использован для расчета константы равновесия и определения предельного состава реакционной смеси.
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Зависимость и изменение химического равновесия
Химическое равновесие в системе зависит от ряда факторов, которые могут изменять его положение. Факторы, влияющие на химическое равновесие, включают изменение концентрации реагентов или продуктов, изменение давления и температуры системы.
Изменение концентрации реагентов или продуктов может вызвать смещение равновесия в ту или иную сторону. Если концентрация одного из компонентов системы увеличивается, равновесие будет смещено в сторону образования продуктов. Если концентрация продуктов увеличивается, равновесие будет смещено в сторону образования реагентов.
Изменение давления также может повлиять на положение химического равновесия. Если в систему введено дополнительное вещество, сильно сжимающееся или сильно растягивающееся, равновесие будет смещено в сторону меньшего числа молекул, чтобы компенсировать изменение давления. Напротив, если система сжимается, равновесие будет смещено в сторону большего числа молекул.
Температура является еще одним фактором, способным изменять положение химического равновесия. В общем случае, повышение температуры обычно приводит к смещению равновесия в сторону реакции, которая поглощает тепло. Если реакция является экзотермической (выделяет тепло), повышение температуры приведет к смещению равновесия в сторону образования реагентов.
В зависимости от конкретной реакции и условий, возможны различные изменения химического равновесия. Понимание этих изменений позволяет управлять равновесием и повышать эффективность многих химических процессов.
📺 Видео
Обратимые и необратимые реакции | Химическое равновесие и условия его смещенияСкачать

Химическое равновесие в промышленных процессах. 10 класс.Скачать

Влияние различных факторов на равновесие. Принцип смещения равновесия - Ле Шателье-Брауна. 10 класс.Скачать

Условия смещения химического равновесия. 9 класс.Скачать

83. Химическое равновесиеСкачать

Смещение химического равновесия - ЭКСПЕРИМЕНТЫСкачать

Химическое равновесие в растворахСкачать

Химическое равновесие: как его сместить? #химическое равновесие #химшкола #видеоурок #егэхимияСкачать

Химическое равновесие. Видеоурок 40. Химия 9 классСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 2 часть. 9 класс.Скачать

Химическое равновесие | Химия ЕГЭ, ЦТСкачать

Химическое равновесие. Закон действующих масс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Химическое равновесиеСкачать

Химическое равновесие / Смещение химического равновесияСкачать

При́нцип Ле Шателье́. Пример (видео 4) | Химическое равновесие | ХимияСкачать
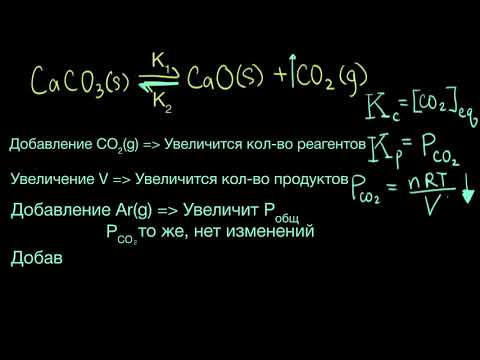
ХИМИЯ 11 класс : Обратимость химических реакций. Химическое равновесие и способы его смещенияСкачать

