Азот (N) — это химический элемент, который играет важную роль в биохимии, сельском хозяйстве и промышленности. Однако, несмотря на свою распространенность и важность, азот не обладает валентностью 5, что может вызывать некоторое изумление у студентов химии и ученых. Почему так происходит? В этой статье мы рассмотрим пять причин и объяснения этого явления.
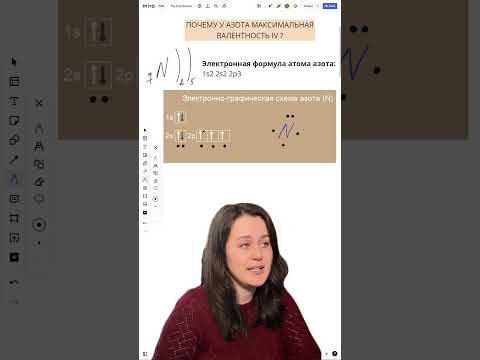
1. Электронная конфигурация азота: Одной из основных причин отсутствия у азота валентности 5 является его электронная конфигурация. Азот имеет атомное число 7, и в своем основном состоянии он имеет электронную конфигурацию 1s2 2s2 2p3. У атома азота имеется всего пять электронов в своей внешней электронной оболочке, что делает невозможным образование дополнительных связей и расширение своей валентности.
2. Геометрическая структура молекулярного азота: Молекулярный азот (N2) образуется из двух атомов азота, связанных тройной связью. Эта тройная связь обеспечивает молекуле азота максимально возможную степень насыщения и стабильность. Отсутствие дополнительных связей в молекуле азота делает его валентность неизменной и равной 3.
3. Валентность азота в различных соединениях: Азот формирует различные соединения с другими элементами, в которых его валентность может быть различной. Например, в соединении NH3 азот имеет валентность 3, образуя три связи с водородом. В соединениях NO2, NO3 и N2O5 азот имеет валентность 5, образуя пять связей с другими элементами. Однако, валентность 5 для азота возможна только в данных соединениях и не является его общей характеристикой.
4. Энергетическая стабильность азота: Аллотропная форма азота, известная как диазот (N2), является наиболее стабильной и распространенной формой в природе. Для образования 5 валентных связей азоту нужноиспользовать больше энергии, что ухудшает его общую энергетическую стабильность. Поэтому азот сохраняет свою валентность на уровне 3, чтобы обеспечить максимальную стабильность своих молекул.
5. Другие элементы с валентностью 5: Валентность 5 не является универсальной характеристикой для всех элементов. Некоторые элементы, такие как фосфор (P) и арсений (As), могут формировать соединения, в которых их валентность равна 5. Однако азот не имеет необходимости в такой валентности, поскольку его основные функции и химические свойства остаются неизменными и валентность 3 предоставляет ему достаточную степень реактивности и стабильности.
Таким образом, несмотря на свою важность и присутствие во многих соединениях, азот сохраняет свою валентность на уровне 3 из-за своих особенностей электронной конфигурации, молекулярной структуры и энергетической стабильности. Понимание этого факта поможет лучше понять химическую природу азота и его роль в различных процессах и системах.
Видео:ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Причины отсутствия валентности 5 у азота
- Строение атома азота: Атом азота имеет электронную конфигурацию 1s2 2s2 2p3, что означает, что у него есть 5 электронов в внешней оболочке. Однако, несмотря на наличие пяти электронов, атом азота не может образовать пять валентных связей. Это связано с особенностями распределения электронной плотности.
- Закономерности химической связи: Валентность атома определяется его способностью образовывать связи с другими атомами. Закономерности химической связи показывают, что атом может образовывать столько валентных связей, сколько он имеет свободных электронных пар. У азота есть только три свободные электронные пары, и, следовательно, он может образовать только три валентные связи.
- Энергетические соображения: Образование пяти валентных связей требует большой энергии и нестабильно. Взаимодействие пяти атомов азота, каждый из которых образовывает по пять валентных связей, потребовало бы значительного количества энергии. Поэтому, на практике, азот образует только три валентные связи, чтобы достичь наиболее стабильного состояния.
Таким образом, отсутствие валентности 5 у азота обусловлено его электронной конфигурацией, закономерностями химической связи и энергетическими соображениями. Азот образует только три валентные связи, что делает его химические свойства особенными и важными для множества процессов и реакций в природе и промышленности.
Строение атома азота
Электронная оболочка атома азота состоит из двух энергетических уровней, на первом уровне находится 2 электрона, а на втором — 5 электронов. На втором уровне электроны располагаются в трех энергетических подуровнях: s, p и d.
В основном состоянии атом азота имеет электронную конфигурацию 1s2 2s2 2p3. Это значит, что на внешнем энергетическом уровне у азота находятся 3 несвязанных электрона. Такая электронная конфигурация не позволяет азоту образовывать валентность 5, так как для этого необходимо иметь 5 свободных электронов во внешнем энергетическом уровне.
Электроны на втором энергетическом уровне атома азота распределены по следующему принципу: два электрона находятся в s-подуровне, который заполняется первым, и три электрона в p-подуровне. Поскольку p-подуровень образовывает три пустые орбитали, атом азота может образовывать до трех ковалентных связей.
Именно эти три свободные орбитали в п-подуровне азота могут участвовать в образовании связей с другими атомами. При этом в каждой связи азот будет делить по одному из своих трех электронов с атомом другого элемента, образуя трехцентровую, двухэлектронную связь.
Таким образом, атом азота имеет особенную электронную конфигурацию, которая предопределяет его способность образовывать трехцентровые связи и объясняет отсутствие валентности 5 у азота.
Особенности электронной конфигурации
Если посмотреть настроение электронов в атоме азота, то можно заметить, что два электрона занимают первую энергетическую оболочку (K-оболочку), а оставшиеся пять электронов заполняют вторую энергетическую оболочку (L-оболочку).
Важно отметить, что L-оболочка может вместить до 8 электронов, однако у азота она заполнена всего на 5 электронов. Это значит, что азот имеет 3 непарных электрона, что делает его атом нестабильным и склонным к реакциям с другими атомами.
На основе электронной конфигурации азота можно объяснить его способность образовывать трехвалентные соединения. Трехвалентность связана с тем, что азот может поделить свои непарные электроны с другими атомами, образуя три химические связи. Так как азот имеет 5 электронов во внешней оболочке, он стремится завершить эту оболочку, образуя связи с другими атомами, чтобы достичь стабильности.
Однако, остается вопрос, почему азот не образует пентавалентные соединения, то есть не может образовывать 5 химических связей. Здесь снова причина кроется в электронной конфигурации. Атом азота не способен распределить 5 электронов на L-оболочку равномерно, так как это противоречит его энергетическим особенностям.
Таким образом, особенности электронной конфигурации азота объясняют его способность образовывать трехвалентные соединения и одновременно свидетельствуют о невозможности образования пентавалентных связей. Это является важным аспектом для понимания химической активности азота и его реакционной способности.
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Объяснения отсутствия валентности 5 у азота
У азота отсутствует валентность 5 по нескольким причинам:
1. Строение атома азота. Атом азота имеет электронную конфигурацию 1s2 2s2 2p3. Внешний электронный уровень состоит из трех электронов, что позволяет атому образовывать максимум три связи с другими атомами. |
2. Особенности электронной конфигурации. Атом азота имеет единственный свободный p-орбитальный электрон, который может участвовать в образовании связей. Следовательно, азот способен образовывать только три ковалентных связи. |
3. Закономерности химической связи. Согласно законам химической связи, для того чтобы атом образовал пять связей, он должен иметь пять свободных p-орбиталей. У азота же есть только одна свободная p-орбиталь, что не позволяет формировать пять связей. |
4. Распределение электронной плотности. В случае, если азот образует пять связей, решетчатая электронная плотность вокруг азота окажется очень высокой, что ведет к электронно-отрицательному заряду азота. Для поддержания максимальной стабильности, атом азота предпочитает образовывать меньшее количество связей и иметь более низкую электронную плотность. |
В результате данных физических и химических факторов азот образует только три связи, что объясняет отсутствие валентности 5 у данного элемента.
Закономерности химической связи
Одной из таких закономерностей является октетное правило, согласно которому атомы стремятся образовывать такие связи, чтобы окружающие их атомы заполняли свои внешние энергетические оболочки восемью электронами. Это состояние называется стабильным октетом.
В случае азота, который имеет электронную конфигурацию 1s^2 2s^2 2p^3, то есть всего 5 электронов в валентной оболочке, это правило не выполняется. Однако атом азота стремится достичь стабильности, поэтому он образует связи с другими атомами или ионами для заполнения внешней оболочки электронами.
Различия в электроотрицательности между атомами определяют положительность и отрицательность атомов ионов, что обуславливает образование ионной связи или полярной ковалентной связи. Оба вида химической связи помогают атому азота достичь стабильности путем заполнения внешней оболочки.
Знание закономерностей химической связи позволяет понять механизмы образования соединений и предсказывать их свойства. Это является фундаментальным основанием для изучения химической реактивности и разработки новых материалов и соединений.
Распределение электронной плотности
Распределение электронной плотности в атоме азота определяет его химические свойства и способность к образованию химических связей. Атом азота имеет электронную конфигурацию 1s^2 2s^2 2p^3, что означает наличие пяти электронов в валентной оболочке.
Однако, атом азота не образует соединений с пятью различными атомами других элементов, поэтому говорят, что у азота нет валентности 5. Это можно объяснить тем, что при образовании химической связи атом азота может поделить свои электроны только с четырьмя другими атомами, образуя четыре связи.
Распределение электронной плотности в атоме азота зависит от его электронной конфигурации и строения. Атом азота имеет две оболочки — внутреннюю и внешнюю, включающие в себя 7 электронов.
Внутренняя оболочка, состоящая из двух электронов в s-орбиталях, полностью заполнена и стабильна. Внешняя оболочка, включающая 5 электронов в p-орбиталях, не заполнена до конца и более подвижна.
Распределение электронной плотности в азоте происходит таким образом, что четыре электрона из внешней оболочки участвуют в образовании тетраэдрической структуры, образующей четыре связи с другими атомами. Пятый электрон остается непарным и формирует свободную электронную пару.
Это свободное электронное состояние делает атом азота хорошим акцептором электронов, способным образовывать координатные связи с другими атомами, такими как кислород. Таким образом, атом азота может участвовать в образовании разнообразных химических соединений, но не образует валентности 5 с атомами других элементов.
🌟 Видео
Почему азот четырехвалентный/ ВАЛЕНТНОСТЬ АЗОТАСкачать
Валентность. Учимся определять валентность элементов по формуламСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Максимальная валентность азота #химия #химияскатей #химияпросто #химияегэ #химияогэ #егэхимияСкачать

Азот: химические свойства и особенности | Химия ОГЭ 2023 | УмскулСкачать

Химия. Валентные возможности азота. Центр онлайн-обучения «Фоксфорд»Скачать

Валентность азотаСкачать

Валентность Азота#shortsСкачать

Валентность азота #химия#егэ#огэСкачать

Валентные возможности атома. Метод валентных связей (МВС).Скачать

Азот и его соединения: химические свойства #азот #химшкола #неметаллы #егэхимияСкачать

Как БЫСТРО определить ВАЛЕНТНОСТЬ #shorts #youtubeshortsСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Валентность и степень окисления | Химия ЦТ, ЕГЭСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Возбужденное состояние атома | Химия ЕГЭ | УмскулСкачать

СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

