Углерод – это химический элемент с атомным номером 6, и он является основой огромного количества органических соединений. Одна из наиболее удивительных особенностей углерода – это его способность формировать четыре химические связи с другими атомами. Эта валентность 4 имеет несколько ключевых причин, определяющих уникальные свойства и многообразие соединений, которые образуются с его участием.
Первая причина валентности 4 углерода – его электронная конфигурация. Углерод имеет 4 электрона в внешней оболочке, что позволяет ему установить четыре связи с другими атомами. Это обеспечивает углероду стабильность и возможность образования различных соединений.
Вторая причина связана с особенностями строения углеродного атома. Углерод имеет четыре валентные электронные области, которые могут связываться с другими атомами. Это позволяет углероду образовывать различные геометрические формы, такие как прямолинейные цепочки, кольца и трехмерные структуры. Благодаря этому углерод может образовывать огромное количество различных соединений, включая сложные органические молекулы.
Третья причина связана с силой углерод-углеродных связей. Связи между атомами углерода являются очень крепкими и стабильными, что позволяет образовывать молекулы с различными свойствами и структурами. Это делает углерод основным строительным блоком жизни и позволяет существование огромного разнообразия органических соединений, от простейших до очень сложных.
Видео:Оксид углерода IV. Способы получения и химические свойства | ХимияСкачать

Пролог главы 1
Первая причина:
Углерод обладает валентностью 4 по нескольким причинам. Во-первых, у него есть 4 валентных электрона во внешнем энергетическом уровне. Именно эти электроны определяют реактивность углерода и его способность образовывать связи с другими элементами.
Во-вторых, углерод имеет электронную конфигурацию 1s2 2s2 2p2. Это означает, что у него есть два электрона в s-орбитали и два электрона в p-орбитали. Поскольку p-орбиталь может вместить максимум 6 электронов, углерод может принять еще два электрона, чтобы заполнить свои p-орбитали.
Третья причина заключается в том, что углерод образует стабильные и прочные ковалентные связи с другими элементами, включая другие атомы углерода. Это связано со способностью углерода образовывать двойные и тройные связи, что позволяет ему образовывать разнообразные химические соединения.
Наконец, четвертая причина связана с тетраэдрической геометрией углеродных соединений. В каждом углеродном атоме четыре электрона образуют четыре связи вокруг себя, образуя тетраэдральную структуру. Это позволяет углероду образовывать различные конфигурации и обеспечивает его многообразие химических соединений.
Вторая причина:
Атом углерода стремится достичь стабильности, заполнив свой внешний энергетический уровень. Так как внешний уровень может вместить максимум 8 электронов, углероду необходимо добавить 4 электрона, чтобы достичь этой стабильности.
Углерод может образовывать 4 ковалентные связи с другими атомами, передавая или принимая электроны. Это позволяет углероду образовывать разнообразные органические соединения, такие как углеводы, липиды, белки и нуклеиновые кислоты, которые являются основными компонентами жизни на Земле.
Ковалентная связь углерода с другими атомами может быть одиночной, двойной или тройной, что дает углероду возможность образовывать различные структуры и свойства соединений.
Валентность 4 углерода делает его уникальным элементом среди других элементов периодической таблицы, и является ключевым фактором в возникновении и разнообразии органических соединений.
Видео:ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Пролог главы 2
В предыдущей главе мы рассмотрели первые две причины, по которым углерод имеет валентность 4. Теперь перейдем к прологу главы 2, где мы рассмотрим еще две причины.
Первая причина, по которой углерод обладает валентностью 4 — это наличие 4 электронов в его внешнем энергетическом уровне. Каждый углеродовый атом имеет электронную конфигурацию 1s2 2s2 2p2. Это означает, что внешний энергетический уровень углерода содержит 4 электрона, которые могут быть общими с другими атомами.
Вторая причина заключается в способности углерода к образованию ковалентных связей. Углерод имеет 4 валентных электрона, которые могут участвовать в образовании ковалентных связей с другими атомами. Каждый электрон может образовать одну ковалентную связь с другим атомом, и таким образом, углерод может образовывать до 4 ковалентных связей.
В результате, углерод может формировать разнообразные структуры и соединения, такие как алканы, алкены, алкины, алкоголи, карбонильные соединения и многие другие. Это делает углерод одним из самых важных элементов для органической химии и жизни в целом.
Первая причина:
Первая причина валентности 4 у углерода заключается в его электронной конфигурации. У атома углерода есть 6 электронов, которые распределяются по его энергетическим оболочкам. Внешняя оболочка углерода состоит из 4 электронов, что делает его валентность равной 4.
Валентность атома определяется числом электронов в его внешней оболочке. Углерод находится во втором периоде периодической таблицы и имеет две оболочки: первую оболочку с двумя электронами и вторую оболочку с четырьмя электронами. Таким образом, валентность углерода равна числу электронов в его внешней оболочке, то есть 4.
Электроны во внешней оболочке атома углерода могут образовывать химические связи с другими атомами, чтобы достичь стабильной конфигурации. Углерод имеет возможность образовывать 4 ковалентные связи, так как его валентность равна 4. Это позволяет углероду образовывать разнообразные соединения с другими элементами.
Таким образом, первая причина валентности 4 у углерода связана с его электронной конфигурацией и наличием 4 электронов во внешней оболочке. Это делает углерод основным элементом органической химии и позволяет ему образовывать множество разнообразных соединений.
Вторая причина:
Если углерод принимает 4 электрона, он образует отрицательный ион с зарядом -4. Такой ион называется карбид-ионом. Например, при взаимодействии углерода с кислородом вода образуется и карбид-ион.
Если углерод отдает 4 электрона, он образует положительный ион с зарядом +4. Такой ион называется карбоний-ионом. Например, в молекуле метана, углерод отдает свои электроны четырем водородным атомам, образуя 4 карбония.
Электронная конфигурация углерода с 4 неспаренными электронами на внешнем уровне делает его способным к образованию четырех ковалентных связей. Это означает, что углерод может образовывать стабильные химические соединения с другими атомами, включая атомы углерода, такие как метан (CH4), этан (C2H6) и многие другие.
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Пролог главы 3
Углерод, будучи четвертою причиной столь мощной валентности, оказывает невероятное влияние на свойства и химические реакции органических соединений. Эта валентность, равная 4, обусловлена рядом факторов, которые делают углерод основным «строительным камнем» жизни на Земле.
- Первая причина: Строение атома углерода. Углерод имеет электронную конфигурацию 1s2 2s2 2p2. Внешний электронный уровень имеет 4 электрона, что позволяет атому углерода образовывать четыре ковалентные связи. Это обусловлено наличием дополнительных p-орбиталей, которые могут вступать в связи с другими атомами.
- Вторая причина: Гибкость молекул углеродных соединений. Благодаря возможности образования четырех ковалентных связей, углерод может образовывать различные структуры и связи с другими атомами. Это позволяет ему создавать огромное разнообразие органических молекул, включая углеводороды, карбонаты, белки и многие другие соединения.
Первая причина:
Первая причина, по которой углерод имеет валентность 4, заключается в его электронной конфигурации. В атоме углерода находятся 6 электронов: 2 внутренних и 4 валентных. Валентные электроны находятся на последней энергетической оболочке и могут участвовать в химических реакциях.
Электронная конфигурация атома углерода — 1s^2 2s^2 2p^2. Это означает, что на первой энергетической оболочке находятся 2 электрона, а на второй — 4 электрона.
Из-за наличия 4 валентных электронов углерод имеет возможность образовывать 4 ковалентных связи с другими атомами, что делает его особенно важным и универсальным элементом в органической химии. Благодаря этой особенности углерода возможно образование различных органических соединений, таких как углеводороды, аминокислоты, жиры, и другие вещества, которые являются основой для жизни на Земле.
Таким образом, причина, по которой углерод имеет валентность 4, заключается в его электронной конфигурации, обеспечивающей углероду возможность образовывать 4 ковалентные связи и образование различных органических соединений.
Вторая причина:
В валентной оболочке у простого атома углерода находится 4 электрона. Заполняя эти электроны по схеме Хунда, все 4 электрона размещаются в отдельных орбиталях. Это означает, что эти электроны находятся на различных уровнях энергии, что позволяет углеродному атому образовывать связи с более чем одним атомом.
Таким образом, благодаря наличию 4 электронов в рабочей оболочке углерод способен образовывать 4 связи с другими атомами, что делает его валентность равной 4. Эта особенность делает углерод основой огромного разнообразия органических соединений, формирующих основу жизни на Земле.
📽️ Видео
Химия. 9 класс (Урок№17 - Углерод. Аллотропные модификации углерода.Химические свойства. Адсорбция.)Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Валентные состояния атома углерода в органических соединениях | ХимияСкачать

Валентность и степень окисления | Химия ЦТ, ЕГЭСкачать

Эта САМАЯ ВАЖНАЯ тема в Химии. Что нужно знать про ВАЛЕНТНОСТЬ? (Химия для начинающих)Скачать

Гибридизация для школьников, валентные состояния атома углерода (sp, sp², sp³)Скачать

Валентные состояния атома углерода. Химия 10 классСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Почему углерод присутствует везде? (видео 4) | Crash course | Partner ContentСкачать

Углерод. Видеоурок 33. Химия 9 классСкачать

ВСЯ ХИМИЯ за 10 класс в 1 уроке + таймкодыСкачать

22. Определение валентностиСкачать

Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать

Почему азот четырехвалентный/ ВАЛЕНТНОСТЬ АЗОТАСкачать
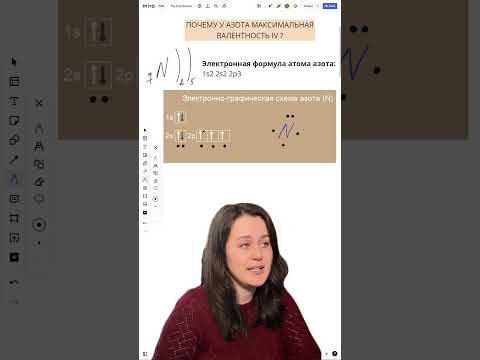
Химия 8 класс (Урок№32 - Валентность и степень окисления. Правила определения степеней окисления.)Скачать

