Вода – одно из самых распространенных и изучаемых веществ на Земле. Однако, мы часто не задумываемся о том, какими особенностями обладает этот на первый взгляд обычный состав. Одним из ключевых свойств, определяющих многие его аспекты, является полярность.
Полярность воды заключается в наличии двух разных зарядов в его молекуле, что делает его полярным соединением. По сравнению с другими неорганическими веществами, которые обычно не обладают полярностью, вода обнаруживает ряд уникальных свойств и особенностей, которые объясняются именно этой особенностью.
Первое свойство, которое определяется полярностью воды, – ее способность растворять другие вещества. Именно благодаря полярности молекул воды она может легко образовывать водородные связи с другими полярными молекулами. Это делает воду отличным растворителем для многих ионных и полярных соединений, обеспечивая максимальное распространение их в водной среде.
Кроме того, полярность воды также влияет на ее высокую поверхностную силу. Молекулы воды на поверхности образуют сильные водородные связи между собой и с молекулами внизу, что обеспечивает явление капиллярности и способствует подъему воды в узких капиллярах, например, в растениях.
Также, вода благодаря своей полярной структуре обладает высокой теплоемкостью и теплопроводностью. Это означает, что вода имеет способность поглощать и отдавать много тепла без значительного изменения своей температуры. Благодаря этому, вода регулирует климатические условия, умеренный обогревает окружающую среду и позволяет организмам поддерживать постоянную внутреннюю температуру.
Видео:Как полярность заставляет воду менять свои свойстваСкачать
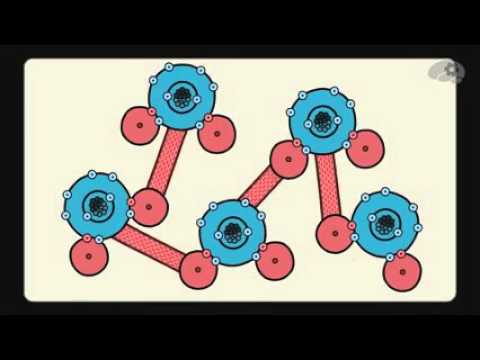
Свойства воды, объясняемые ее полярностью
Благодаря этой полярности вода обладает свойством высокой растворимости различных субстанций. Она способна растворять множество ионов и молекул, образуя растворы с многими веществами, с которыми неполярные растворители не смогут справиться.
Полярность воды также влияет на ее поверхностное натяжение — силу, с которой молекулы группируются на поверхности жидкости, образуя пленку. Вода обладает высоким поверхностным натяжением, что обуславливает ее способность образовывать капли и поддерживать плавучие объекты, такие как насекомые, на ее поверхности.
Кроме того, одной из ключевых характеристик воды является ее универсальность в качестве растворителя. Благодаря своей полярности, вода способна растворять различные соли, газы, органические и неорганические соединения. Это делает ее идеальным средством для транспортировки их в живых организмах.
Кроме этого, полярность воды обуславливает ее высокую теплоемкость. Вода способна поглощать и отдавать большое количество тепла без существенного изменения своей температуры, что важно для поддержания стабильной температуры окружающей среды и жизни на Земле.
В целом, свойства воды, связанные с ее полярностью, сделали ее одним из самых уникальных и важных веществ в природе. Они являются основой для многих биологических и химических процессов и обеспечивают поддержание жизни на нашей планете.
Видео:Мультфильм "Секреты воды"Скачать

Терминология полярности воды
Полярность воды обусловлена присутствием двух дипольных связей между водородом и кислородом, которые делят электронные пары неравномерно. Кислород притягивает электроны сильнее, что делает его отрицательно заряженным, в то время как водород становится положительно заряженным.
Однако, положительный и отрицательный заряды воды не отделяются друг от друга в пространстве как отдельные частицы, а являются частями единой молекулы. Полярность воды создает возможность для образования специфических связей с другими молекулами, что определяет ее особые свойства и роль в биологических и химических процессах.
Благодаря полярности, вода способна образовывать водородные связи с другими полярными веществами, такими как спирты, аминокислоты и некоторые полимеры. Водородные связи являются важным фактором во многих биологических процессах, таких как образование пространственной структуры белков и стабилизация молекул ДНК.
Полярность воды также объясняет ее поверхностное натяжение — способность образовывать пленку на поверхности, которая делает ее устойчивой к разрыву и позволяет насекомым передвигаться по воде. Поверхностное натяжение воды играет роль во многих физических явлениях, таких как капиллярное действие и планетарные океаны.
Кроме того, полярность воды делает ее универсальным растворителем. Вода способна растворять множество поларных и ионных веществ, таких как соли и сахар. Как растворитель, вода играет ключевую роль в биологических системах, таких как клетки, где она обеспечивает транспорт и реакции различных молекул.
В целом, понимание терминологии полярности воды помогает нам лучше понять ее особенности и уникальные свойства, которые играют важную роль во многих аспектах нашей физической и биологической окружающей среды.
Полярные молекулы
Вода — один из самых ярких примеров полярной молекулы. У водной молекулы две валентные связи между атомом кислорода и атомами водорода. Атом кислорода, являющийся электроотрицательным, притягивает электроны сильнее, чем водород, что приводит к образованию отрицательного и положительного зарядов.
Полярные молекулы имеют ряд особенностей. Они обладают сильной полярностью, что обуславливает такие свойства воды, как ее растворяющая способность и поверхностное натяжение. Полярность также влияет на температурные свойства воды, такие как ее теплоемкость и способность к изменению температуры.
Полярные молекулы также способны взаимодействовать друг с другом через водородные связи. В воде между молекулами образуются водородные связи, которые делают ее уникальным веществом с высоким кипящим и плавительным точками по сравнению с другими веществами.
Полярные молекулы проявляют свою полярность и взаимодействуют с неполярными молекулами. Вода может образовывать гидраты с неполярными веществами, такими как масла, благодаря своей полярности и способности образовывать взаимодействия с неполярными молекулами.
Таким образом, понимание полярности молекулы воды и ее свойств при взаимодействии с другими веществами играет важную роль в объяснении многих физических и химических процессов, в которых участвует вода.
5. Неполярные молекулы
Примером неполярной молекулы является молекула кислорода (O2), в которой два атома кислорода соединены двойной связью и не имеют разделенных зарядов. Такие молекулы обычно не образуют водородных связей и не растворяются в воде.
Неполярные молекулы также включают газы, такие как азот (N2), метан (CH4) и этилен (C2H4). Все эти молекулы не имеют полюсности и не образуют структуры, подобные тем, которые образуются в воде.
Неполярные молекулы имеют важное значение в различных процессах, таких как растворение в неполярных растворителях, образование нефти и газа, а также воздействие на физические свойства вещества, например, точку кипения и плотность.
Видео:Что же такое ВОДА на самом деле? | DeeaFilmСкачать

Водородные связи и поверхностное натяжение
Водородные связи представляют собой электростатические взаимодействия между атомами воды. Отличительной особенностью водородной связи является сильное взаимодействие положительно заряженного водородного атома одной молекулы воды и отрицательно заряженного атома кислорода соседней молекулы. Это приводит к образованию устойчивых структур водной сетки.
| Свойства водородных связей | Объяснение |
|---|---|
| Высокая кипящая точка | Водородные связи создают прочное соединение между молекулами воды, что требует большого количества энергии для разрыва связей и перехода воды в парообразное состояние. |
| Высокая плотность в жидком состоянии | Водородные связи приводят к формированию плотной структуры воды, что делает ее плотность в жидком состоянии выше, чем у большинства других веществ. |
| Высокое теплотекущее кол-во (теплоемкость) | Водородные связи способствуют накоплению большого количества теплоты в воде при нагревании и рассеиванию этой теплоты при охлаждении, что делает воду хорошим теплоносителем. |
Поверхностное натяжение воды обусловлено силами, действующими на молекулы воды на ее поверхности. Водородные связи создают особую структуру на границе между водой и воздухом, что приводит к образованию пленки с высокой поверхностной тензией. Это объясняет возможность образования капель, пузырей и поддержания их формы.
Водородные связи в воде
В каждой молекуле воды имеются две водородные связи. Кислородный атом в молекуле воды обладает высокой электроотрицательностью, что делает его частично отрицательно заряженным. Атом водорода, связанный с этим кислородным атомом, приобретает частично положительный заряд. Подобные заряды притягиваются друг к другу, образуя водородные связи.
Водородные связи в воде обладают высокой прочностью и являются сильными притяжениями между молекулами. Они отвечают за высокую температуру кипения воды, так как для их разрыва требуется значительное количество энергии. Кроме того, водородные связи способствуют образованию упорядоченной структуры льда, благодаря которой лед легче воды и способен плавать.
Водородная связь также отвечает за поверхностное натяжение воды. Воздействие водородных связей на поверхностный слой молекул воды заставляет его сжиматься, создавая пленку с поверхностным натяжением. Это обеспечивает устойчивость и прочность поверхностей воды и позволяет некоторым организмам ходить по воде.
Водородные связи в воде играют важную роль в ее способности действовать как универсальный растворитель. Кислородный атом воды образует связи не только с водородом, но и с другими атомами и ионами. Это позволяет воде растворять множество различных веществ, так как водородные связи между молекулами воды и молекулами растворенного вещества могут замещаться другими связями.
- Водородные связи в воде обусловливают множество ее уникальных свойств.
- Они объясняют высокую температуру кипения воды и упорядоченную структуру льда.
- Водородные связи отвечают за поверхностное натяжение воды и ее способность действовать как универсальный растворитель.
Поверхностное натяжение воды
Водородные связи – это силы притяжения между атомом водорода одной молекулы и атомами кислорода или азота другой молекулы. Они создаются из-за полярности воды. Водородные связи сильны и могут приводить к образованию структуры поверхностной пленки.
Такое поведение воды объясняет ее поверхностное натяжение – способность образовывать тонкую пленку на своей поверхности. Именно благодаря этому свойству вода может формировать капли и капельки на поверхности твердых тел. Они образуются из-за водородных связей, создаваемых между молекулами воды.
У поверхностного натяжения воды есть ряд интересных свойств. Например, благодаря этому явлению на поверхности воды могут располагаться некоторые насекомые, которые могут ходить по воде без тонкоземлеводными своих ног. Кроме того, поверхностное натяжение воды позволяет ей образовывать пузырьки и пены.
Также следует отметить, что поверхностное натяжение воды имеет важное значение для живых организмов. Оно позволяет растениям транспортировать воду по стеблю и веткам. Кроме того, это свойство воды способствует поддержанию формы клеток и их взаимодействию друг с другом.
- Поверхностное натяжение воды – это свойство образовывать пленку на поверхности.
- Это свойство объясняется водородными связями между молекулами воды.
- Поверхностное натяжение воды имеет важное значение для насекомых, растений и живых организмов.
Видео:Вода, которой не должно бытьСкачать

Универсальный растворитель и теплоемкость
Полярность воды играет важную роль в ее способности действовать как универсальный растворитель. Благодаря своей полярной структуре, вода способна растворять множество различных веществ, в том числе соли, сахары, кислоты и многое другое. Это объясняется тем, что полярные молекулы веществ при контакте с водой взаимодействуют с ее полярными частями, образуя водородные связи.
Вода также обладает высокой теплоемкостью, что означает, что ее температура изменяется медленно при нагревании или охлаждении. Это свойство воды играет важную роль в регулировании климата Земли, так как океаны и водные массы способны поглощать большое количество тепла и выпускать его, поддерживая относительно стабильные температуры на планете.
Универсальность воды как растворителя и ее высокая теплоемкость делают ее важным компонентом жизни на Земле. Вода участвует во многих биологических процессах в организмах, обеспечивая транспорт питательных веществ, регулирование температуры и поддержание структуры клеток.
Универсальность растворителя
Универсальность растворителя воды объясняется ее повышенной поларностью и сильными взаимодействиями между молекулами. Вода может растворять как полярные, так и неполярные вещества.
Когда полярное вещество попадает в воду, положительные и отрицательные заряды молекул воды притягиваются к зарядам молекул вещества. Это приводит к образованию гидратной оболочки вокруг молекулы вещества и его растворению в воде.
Неполярные вещества, такие как масла и жиры, не обладают зарядами и не могут образовывать водородные связи с молекулами воды. Однако вода все равно может растворять некоторые неполярные вещества благодаря взаимодействию с их поверхностью.
Универсальность растворителя воды особенно важна для жизни на Земле. Вода является основным компонентом клеток и участвует во многих химических реакциях организма. Благодаря своей уникальной способности растворять множество веществ, вода обеспечивает транспорт питательных веществ и газов в организме, поддерживает стабильность внутренней среды и участвует в регуляции температуры.
Таким образом, универсальность растворителя воды является одним из ключевых свойств, обуславливающих ее важность и необходимость для поддержания жизни на планете.
🎦 Видео
Уникальные свойства воды. Химия – просто.Скачать

ПОТРЯСАЮЩИЕ СВОЙСТВА ВОДЫ И ЕЕ РЕАКЦИЯ НА СЛОВА ЧЕЛОВЕКАСкачать

Вода как растворитель (видео 2) | Биологическая роль воды | БиологияСкачать
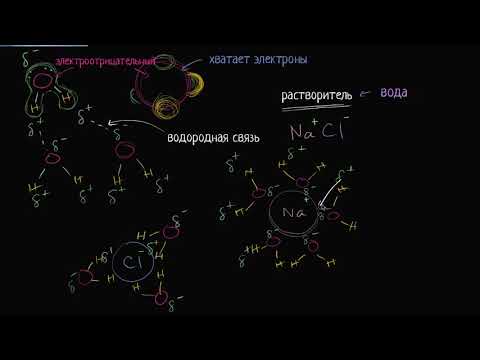
Структура воды, наши слова и мыслиСкачать

Про круговорот воды в природе. Познавательный мультикСкачать

Великая тайна воды (документальный фильм) (HD)Скачать

Водородные связи между молекулами воды (видео 1) | Биологическая роль воды | БиологияСкачать

Вода на Земле | Окружающий мир 2 класс #32 | ИнфоурокСкачать

Вода и её свойства. Изучаем свойства вода. Пальчиковая гимнастика. Занятие для детей. Эксперименты.Скачать

Физика водыСкачать

Вода и её свойства. Значение и охрана воды. 2 класс (учебник Г.В. Трафимова, С.А. Трафимов)Скачать

Химия 8 класс (Урок№14 - Вода в природе и способы её очистки.Физические и химические свойства воды.)Скачать

Свойства воды в жидком состоянии. Видеоурок по окружающему миру 3 классСкачать

Значение воды для живых организмов. 7 класс.Скачать

Ковалентная Полярная Связь — Химическая связь // Химия 8 классСкачать

Свойства воды | ЕГЭ Биология 2023Скачать

