Вода – одно из самых распространенных веществ на Земле. Она присутствует во всех её уголках и играет ключевую роль во многих физических еще явлениях и биологических процессах. Однако, что делает воду такой особенной? Одно из основных свойств воды, обусловленное ее уникальной структурой – это полярность.
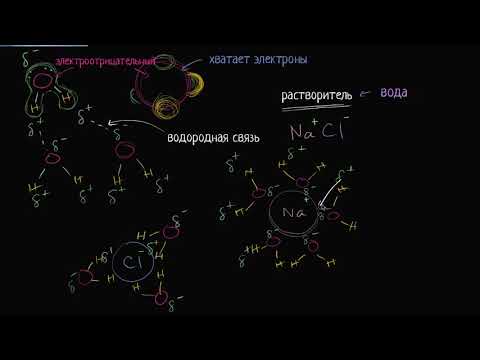
Полярность воды связана с расположением ее атомов. Водный молекулярный кристалл состоит из двух атомов водорода и одного атома кислорода. При этом, электроотрицательность кислородного атома выше, чем у водородных. В результате, электроны в молекуле воды проводят больше времени с кислородом, что делает его негативно заряженным, а водородные атомы оказываются положительно заряженными.
Именно такая уникальная структура молекулы воды делает ее полярной. Благодаря этому свойству, молекулы воды соединяются между собой посредством водородных связей. Полярность позволяет воде образовывать кластеры, или скопления молекул, которые держатся вместе. В результате, молекулы воды образуют устойчивую структуру, где каждая молекула имеет множество соседей, с которыми она связана.
Видео:Структура воды, наши слова и мыслиСкачать

Полярность воды: уникальная структура и свойства
Структура водной молекулы является ключевым фактором для понимания полярности воды. Каждая водная молекула состоит из двух атомов водорода и одного атома кислорода. Атомы водорода располагаются по обе стороны атома кислорода и образуют угол в форме буквы «V».
Благодаря этой уникальной атомной компоновке, вода обладает двумя положительно заряженными частями (водородом) и одной отрицательно заряженной частью (кислородом). Такая разница в зарядах создает электрическую полярность водной молекулы.
Полярность является ключевым свойством воды, определяющим ее особые свойства. Например, благодаря полярности водная молекула обладает способностью образовывать водородные связи. Водородные связи являются слабыми, но имеют важное значение для многих процессов, таких как капиллярное действие и конденсация.
Кроме того, полярность также обусловливает растворительные свойства воды. Вода является отличным растворителем для многих веществ, особенно для поларных соединений, таких как соль и сахар. Это свойство делает воду необходимой для жизни всех организмов на Земле.
Видео:Структура водыСкачать

Структура водной молекулы
Особенность структуры водной молекулы заключается в том, что электроны, участвующие в образовании связи между атомами водорода и кислорода, не распределены равномерно. В результате этого наблюдается неравномерное распределение электронной плотности, что делает молекулу воды полярной.
Полярность воды связана с разностью электроотрицательностей атомов водорода и кислорода. Атом кислорода имеет большую электроотрицательность, что означает его большую способность притягивать электроны к себе. В результате этого, кислородная сторона водной молекулы приобретает небольшой отрицательный заряд, а водородная сторона – небольшой положительный заряд.
Полярность водной молекулы позволяет ей образовывать водородные связи. Водородные связи – это тип слабой химической связи, которая образуется между отдельными молекулами воды. Они происходят между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом кислорода другой молекулы. В результате образуется специфическая сеть водородных связей, которая придает воде множество уникальных свойств.
Структура водной молекулы также определяет ее растворительные свойства. Полярность молекулы позволяет ей эффективно растворять другие полярные соединения, такие как сахар или соль. Вода также способна образовывать связи с неполярными молекулами, такими как масла или жиры, но эти растворы будут менее стабильными и менее эффективными.
Атомная компоновка водной молекулы
Структура водной молекулы обладает особенной атомной компоновкой, которая обусловливает ее уникальные свойства. Молекула воды состоит из двух атомов водорода (H) и одного атома кислорода (O), объединенных ковалентной связью.
Каждый атом водорода образует одну ковалентную связь с атомом кислорода. Это означает, что электроны, находящиеся в этих связях, между атомами воды, проводят максимальное количество времени возле атома кислорода.
Таким образом, молекула воды приобретает полярную структуру, где атом кислорода приобретает отрицательный заряд, а атомы водорода – положительный заряд. Полярность молекулы воды проявляется в наличии разделения зарядов в молекуле.
Именно атомная компоновка водной молекулы обеспечивает ее полярность, что делает воду одним из самых уникальных химических соединений. Наличие полярности воды является причиной ее множества физических и химических свойств.
Полярность воды: уникальная структура и свойства
Как мы знаем, молекула воды состоит из двух атомов водорода и одного атома кислорода. Атомы водорода обладают положительным зарядом, в то время как атом кислорода имеет отрицательный заряд. Эта особенность приводит к положительной и отрицательной полярности водной молекулы.
Благодаря положительным и отрицательным полюсам, водные молекулы образуют слабые водородные связи друг с другом. Эти связи очень важны для многих физических и химических свойств воды. Например, водородные связи позволяют воде иметь высокую теплоемкость, что означает, что она может поглощать и сохранять большое количество тепла без существенного изменения своей температуры.
Еще одним важным свойством воды, обусловленным ее поларностью, является ее способность действовать в качестве растворителя. Вода легко растворяет множество веществ благодаря своей полярности.
В целом, поларность воды — одно из ключевых свойств, которое делает ее такой особой и полезной веществом для жизни на Земле. Она обладает уникальными свойствами, такими как высокая теплоемкость и растворимость, благодаря которым она играет важную роль во множестве физических и химических процессов.
Видео:Что же такое ВОДА на самом деле? | DeeaFilmСкачать

Полярность как ключевое свойство
Полярность воды играет ключевую роль во многих процессах и явлениях, происходящих в природе. Благодаря ей, вода обладает высокими растворительными свойствами и способностью растворять множество различных веществ. Это позволяет ей быть идеальной средой для химических реакций и биологических процессов в организмах.
Одним из наиболее известных проявлений полярности воды является эффект поверхностного натяжения. Поверхность воды оказывается натянутой, благодаря способности молекул образовывать силы взаимодействия между собой. Именно этот эффект позволяет насекающим живым организмам, например, строить свои лодочки или переправы на воде.
Полярность воды также отвечает за ее способность поглощать и отдавать тепло. Именно благодаря этому свойству вода является отличным теплоносителем, способным регулировать температуру окружающей среды. Это особенно важно для строения и функционирования организмов, так как вода является основным компонентом их клеток и тканей.
Кроме того, полярность воды делает ее необходимой для поддержания жизни на Земле. Благодаря этому свойству вода образует поверхности, по которым могут перемещаться молекулы и ионы, а также обеспечивает эффективный транспорт питательных веществ и кислорода в организмах.
Таким образом, полярность воды является ключевым свойством, определяющим ее уникальную структуру и множество важных функций. Без этой особенности, вода не смогла бы выполнять свою роль в природе и поддерживать живые организмы на планете.
Способность образовать водородные связи
Водородные связи обусловлены полярной структурой молекулы воды. Водородный атом с положительным зарядом притягивается к электроотрицательным атому кислорода с отрицательным зарядом. Это приводит к образованию слабых, но стабильных водородных связей.
Способность воды образовывать водородные связи играет важную роль во многих химических и физических процессах. Водородные связи обеспечивают высокую температуру кипения и плавления воды, по сравнению с другими аналогичными веществами. Данный эффект обусловлен силой водородных связей, которые требуют больше энергии для их разрыва.
Водородные связи также обуславливают высокую удельную теплоемкость и теплопроводность воды, что позволяет ей эффективно поглощать и отдавать тепло. Этот факт имеет большое значение для поддержания стабильной температуры в океанах и водных системах, а также для регулирования климата на планете.
Водородные связи также играют важную роль в растворительных свойствах воды. Водородные связи позволяют воде образовывать гидраты, т.е. связываться с другими молекулами и ионами. Благодаря этому вода способна растворять большинство поларных и многие неполярные вещества, что делает ее универсальным растворителем и необходимым компонентом для множества биологических и химических реакций.
| Свойство | Объяснение |
|---|---|
| Высокая температура кипения и плавления | Водородные связи требуют больше энергии для разрыва |
| Высокая теплоемкость и теплопроводность | Водородные связи обеспечивают эффективное поглощение и отдачу тепла |
| Универсальное растворительное свойство | Водородные связи позволяют образовывать гидраты и связываться с другими веществами |
Растворительные свойства воды
Структура водной молекулы играет ключевую роль в растворительных свойствах воды. Однородная полярность воды обусловлена наличием двух положительно заряженных атомов водорода и одного отрицательно заряженного атома кислорода. Это приводит к образованию диполя с электрическим зарядом, который способен взаимодействовать с другими молекулами и ионами.
Способность образовывать водородные связи является одной из основных причин растворительных свойств воды. Водородные связи возникают между положительно заряженным атомом водорода одной молекулы воды и отрицательно заряженным атомом кислорода другой молекулы. Этот тип связей обладает существенной силой и способен удерживать другие молекулы или ионы в растворе.
Растворительные свойства воды особенно важны для биологических систем. Вода является основным составляющим элементом клеток и играет роль среды для биохимических реакций. Благодаря своей полярности и способности образовывать водородные связи, вода способна растворять и переносить различные вещества, необходимые для жизнедеятельности организмов. Кроме того, растворительные свойства воды позволяют поддерживать стабильность внутренней среды и обеспечивать транспорт веществ в организме.
Наконец, растворительные свойства воды имеют значительное значение и вне биологических систем. Вода широко используется в промышленности, научных исследованиях, пищеварении и других сферах. Благодаря своей уникальной структуре и свойствам, вода является одним из наиболее важных и необходимых растворителей в природе и человеческой жизни.
📸 Видео
Мультфильм "Секреты воды"Скачать

Великая тайна воды (документальный фильм) (HD)Скачать

Уникальные свойства воды. Химия – просто.Скачать

Водородные связи между молекулами воды (видео 1) | Биологическая роль воды | БиологияСкачать

Как полярность заставляет воду менять свои свойстваСкачать
Орбитальная модель молекулы водыСкачать

Аномальные свойства водыСкачать

Физика водыСкачать

Неумывакин. Как сделать структурированную воду.Скачать

Вода как растворитель (видео 2) | Биологическая роль воды | БиологияСкачать
СТАТЬ ЦЕЛИТЕЛЕМ МОЖЕТ КАЖДЫЙ. Научное обоснование чакр биополя и как самому восстановить энергетикуСкачать

Раскрыта структура и строение молекулы воды.Скачать

Структура связей молекул водыСкачать

Факты и удивительные свойства ВОДЫ, вся правда о ВОДЕСкачать

Готовимся к ЕГЭ по химии с нуля. Полярность молекул и связей.Скачать

Как отличать полярные молекулы от неполярных? Дипольный момент.Скачать

Вода (видео 1)| Crash course | Partner ContentСкачать

