Растворимость – важное свойство всякого растворителя и его определение возможно только в привязке к тому или иному веществу. Один растворитель может отлично растворять одни вещества, но быть бесполезным в отношении других. Однако воду считают универсальным растворителем, поскольку она обладает высокой растворимостью.
Вода является одним из ключевых компонентов нашей жизни, и ее свойства имеют огромное значение для многих процессов. Секрет высокой растворимости воды лежит в ее молекулярной структуре. Молекулы воды содержат один положительный и два отрицательных электрических заряда, что делает их полярными.
Полярность воды позволяет ей образовывать водородные связи с другими водными молекулами и с молекулами других веществ. Это способствует сильным электростатическим взаимодействиям и, следовательно, хорошей растворимости веществ в воде. Позитивные и отрицательные заряды притягивают друг друга и образуют стабильные структуры водных растворов.
- Связь между молекулярной структурой растворителя и его растворимостью
- Водородная связь и растворимость
- Полярность и неполярность растворителя
- Влияние температуры на растворимость воды
- Влияние температуры на растворимость воды: теплота растворения вещества
- Расширение и сжатие молекул растворителя при повышении и понижении температуры
- 🔍 Видео
Видео:Растворение. Растворимость веществ в воде | Химия 8 класс #39 | ИнфоурокСкачать

Связь между молекулярной структурой растворителя и его растворимостью
Молекулярная структура растворителя определяет его полюсность или неполярность. Полярные растворители обладают электрическим зарядом и образуют дипольные взаимодействия с другими полярными молекулами. Неполярные растворители не обладают зарядом и образуют только слабые ван-дер-Ваальсовы силы притяжения.
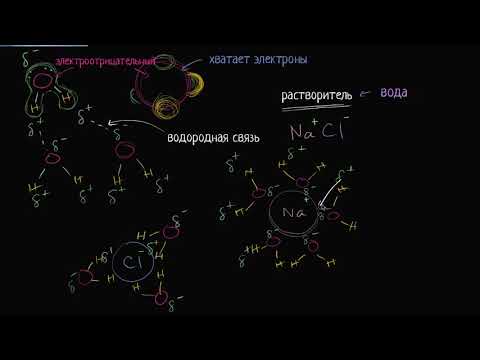
Полярные растворители, такие как вода, способны растворять вещества с полярными молекулами, так как они могут образовывать водородные связи с другими молекулами. Водородная связь возникает между атомом водорода, связанного с электроотрицательным атомом, и электроотрицательным атомом другой молекулы.
Неполярные растворители, например, бензол или толуол, хорошо растворяют неполярные вещества. Это происходит благодаря слабым взаимодействиям между неполярными молекулами.
Таким образом, молекулярная структура растворителя играет важную роль в его растворимости. Полярные растворители, такие как вода, предпочтительно растворяются в полярных веществах, тогда как неполярные растворители лучше растворяют неполярные вещества. Это явление подтверждает важность понимания молекулярной природы растворителей для правильного выбора оптимального растворителя.
Водородная связь и растворимость
Водородная связь является основной причиной того, что молекулы воды обладают высокой координационной способностью и способны растворять разные вещества. Когда вещество растворяется в воде, водородные связи образуются между молекулами растворителя и растворяемого вещества, что позволяет сохранять растворение на микроскопическом уровне.
В растворах водородная связь может проявляться не только между молекулами растворителя и растворенного вещества, но и между молекулами растворенного вещества. Это приводит к тому, что растворенное вещество может быть окружено молекулами растворителя и образовывать глобулы или кластеры в растворе.
Водородная связь играет важную роль не только в растворимости веществ в воде, но и в многих других процессах, таких как формирование трехмерной структуры белка, проводимость воды и свойства многих органических соединений. Это свойство водородной связи является основой для понимания многих жизненно важных процессов и используется в различных областях науки и технологии.
Таким образом, понимание водородной связи помогает объяснить, как и почему различные вещества растворяются в воде и обуславливает множество важных физических и химических свойств воды как растворителя.
Полярность и неполярность растворителя
Неполярные растворители обладают равномерной электрической структурой и не создают положительных и отрицательных частей. Примерами неполярных растворителей являются бензол, гексан, этиловый эфир и другие органические растворители.
Полярные растворители создают положительные и отрицательные части, что позволяет образовывать водородные связи и взаимодействовать с другими полярными веществами. К таким растворителям относятся вода, спирты, уксусная кислота и другие.
Полярные растворители обычно хорошо растворяют полярные вещества, так как их полярные заряды взаимодействуют с полярными зарядами вещества. Неполярные вещества лучше растворяются в неполярных растворителях, так как их одинаково равномерные электрические структуры взаимодействуют друг с другом.
Растворимость вещества в растворителе зависит от степени взаимодействия между молекулами растворителя и растворимого вещества, которая может быть усиленной или ослабленной за счет их полярности или неполярности.
| Полярные растворители | Неполярные растворители |
|---|---|
| Вода | Бензол |
| Этанол | Гексан |
| Метанол | Этиловый эфир |
Таким образом, при выборе растворителя для определенного вещества необходимо учитывать его полярность или неполярность, так как это может существенно влиять на растворимость и процессы взаимодействия молекул вещества.
Видео:Химия 8 класс (Урок№14 - Вода в природе и способы её очистки.Физические и химические свойства воды.)Скачать

Влияние температуры на растворимость воды
Это связано с изменением энергии движения молекул воды при разных температурах. При повышении температуры молекулы воды получают больше энергии, и их движение становится более интенсивным. Это позволяет им легче проникать в межмолекулярные пространства решетки растворяемого вещества и образовывать связи с его молекулами.
Таким образом, при повышении температуры, растворимость вещества обычно увеличивается, поскольку молекулы воды становятся легче проникать в решетку вещества и разрывать существующие связи. Этот процесс называется эндотермическим, так как требуется поглощение тепловой энергии для разрушения взаимодействий между молекулами растворимого вещества.
Однако есть и исключения. Некоторые вещества могут образовывать с водой экзотермические реакции при растворении. В таких случаях, при повышении температуры, растворимость может снижаться. Это связано с тем, что при нагревании происходит выделение тепловой энергии, что компенсирует энергию, которая потребовалась бы для разрушения взаимодействий между молекулами вещества и молекулами воды.
Для наглядности можно представить это в таблице, где будет приведена зависимость растворимости вещества от температуры:
| Температура, °C | Растворимость вещества, г/100 г воды |
|---|---|
| 0 | 10 |
| 20 | 15 |
| 40 | 20 |
| 60 | 25 |
| 80 | 30 |
Из этой таблицы видно, что с повышением температуры растворимость вещества увеличивается.
Таким образом, температура играет важную роль в процессе растворения вещества в воде, и знание зависимости растворимости от температуры может быть полезным при проведении химических экспериментов или промышленных процессов.
Влияние температуры на растворимость воды: теплота растворения вещества
Когда теплота растворения положительна, то при растворении вещества в воде происходит поглощение теплоты из окружающей среды. В таких случаях растворимость вещества обычно увеличивается при повышении температуры. Примером такого вещества является соль. Когда соль растворяется в воде, она забирает теплоту, что приводит к увеличению растворимости.
С другой стороны, когда теплота растворения отрицательна, при растворении вещества в воде выделяется теплота в окружающую среду. В таких случаях растворимость вещества обычно уменьшается при повышении температуры. Примером такого вещества является газ углекислый, который растворяется в воде с выделением теплоты.
Таким образом, теплота растворения вещества играет важную роль в определении его растворимости при разных температурах. Знание о теплоте растворения позволяет предсказывать изменения растворимости вещества при изменении температуры и использовать это знание в практических целях, например, в процессах обработки воды или в производстве химических продуктов.
| Температура | Теплота растворения | Растворимость |
|---|---|---|
| 20°C | 10 кДж/моль | 100 г/л |
| 30°C | 15 кДж/моль | 150 г/л |
| 40°C | 20 кДж/моль | 200 г/л |
Расширение и сжатие молекул растворителя при повышении и понижении температуры
Расширение молекул растворителя при повышении температуры облегчает процесс разрыва связей между молекулами растворенного вещества и образования новых связей с молекулами растворителя. Это приводит к более эффективному перемешиванию молекул и более высокой растворимости вещества в воде.
С другой стороны, при понижении температуры молекулы воды теряют кинетическую энергию и сжимаются. Это приводит к уменьшению промежутков между молекулами и снижению их подвижности.
Сжатие молекул растворителя при понижении температуры затрудняет процессы разрыва и образования связей между молекулами, что влияет на растворимость вещества. Растворимость может снижаться при понижении температуры, поскольку перемешивание молекул становится менее эффективным и процессы образования раствора замедляются.
Понимание взаимосвязи между расширением и сжатием молекул растворителя и их влиянием на растворимость воды является важным для различных применений, например, в химических реакциях, фармакологии и синтезе материалов.
🔍 Видео
Растворы. 8 класс.Скачать

Химия, 8-й класс, Вода, как растворитель. РастворыСкачать

Почему вода растворяет (почти) всё? [Минутка Земли]Скачать
![Почему вода растворяет (почти) всё? [Минутка Земли]](https://i.ytimg.com/vi/sKPaESRqEqo/0.jpg)
Вода как растворитель (видео 2) | Биологическая роль воды | БиологияСкачать
8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Мультфильм "Секреты воды"Скачать

8 класс. Химия. Растворы. Вода - универсальный растворитель. Строение молекулы водыСкачать

"Вода - растворитель", Окружающий мир 3 класс ч.1, с.28-29, Планета знаний.Скачать

Вода – растворитель | Окружающий мир 2 класс #34 | ИнфоурокСкачать

Химия 7 класс. Раствор и его компоненты. Вода - растворитель.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Урок 31. Вода – растворитель. Растворы (8 класс)Скачать

Вода, растворы, растворениеСкачать

Опыт "Вода — растворитель" 💧 3 класс "Окружающий мир"Скачать

Химия 8 Растворы Растворимость веществСкачать

рудзитис химия параграф 33 вода - растворитель растворы 8 классСкачать

РастворыСкачать

