В мире химии силы межмолекулярного взаимодействия играют важную роль в понимании и объяснении различных физических и химических явлений. Благодаря этим силам атомы и молекулы могут связываться друг с другом, образуя разнообразные структуры и соединения. Такое взаимодействие имеет не только основополагающее значение для понимания химических реакций, но и оказывает влияние на свойства и поведение веществ. Исследование сил межмолекулярного взаимодействия позволяет углубить наши знания о химической структуре вещества и создать новые материалы с необычными свойствами.
Существует несколько видов сил межмолекулярного взаимодействия, включая дисперсионные силы, дипольные силы и взаимодействие кулоновских зарядов. Дисперсионные силы, также известные как силы Лондонда, возникают из-за временных изменений амплитуды электронных облаков в атоме или молекуле. Дипольные силы возникают, когда молекулы имеют постоянный дипольный момент, вызванный неравномерным распределением электронной плотности. Взаимодействие кулоновских зарядов возникает между заряженными частицами, такими как ионы или поляризованные молекулы.
Роль сил межмолекулярного взаимодействия в химии заключается в их способности обуславливать свойства и поведение вещества. Например, вода – универсальный растворитель – обладает высокой полярностью, что обусловлено дипольными силами взаимодействия между молекулами воды. Растворительные свойства воды позволяют молекулам других веществ диссоциировать и образовывать растворы. Кроме того, все химические реакции происходят благодаря взаимодействию молекул и атомов, что можно объяснить с помощью сил межмолекулярного взаимодействия.
Видео:Поверхностное натяжение (видео 3) | Силы межмолекулярного взаимодействия | ХимияСкачать
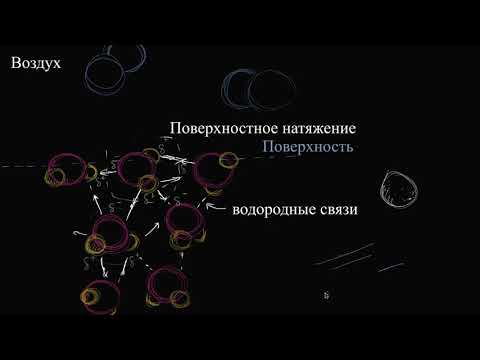
Основные принципы межмолекулярного взаимодействия
Основные принципы межмолекулярного взаимодействия включают такие типы сил, как лондоновская дисперссия, диполь-дипольное взаимодействие и ионно-дипольное взаимодействие.
| Лондоновская дисперссия | Лондоновская дисперссия — это временное возникновение межмолекулярных сил притяжения в неполярных молекулах из-за неравномерного распределения электронной плотности. Данная сила является слабой, но может играть важную роль в формировании молекулярных соединений, особенно в случае больших молекул и органических соединений. |
| Диполь-дипольное взаимодействие | Диполь-дипольное взаимодействие происходит между полярными молекулами, которые обладают постоянным дипольным моментом. Возникающие силы связаны с притяжением положительно и отрицательно заряженных частей молекул друг к другу. Это является одной из сильных форм межмолекулярного взаимодействия и способствует образованию структуры, силы и свойств вещества. |
| Ионно-дипольное взаимодействие | Ионно-дипольное взаимодействие возникает между ионами и полярными молекулами. Ионы обладают зарядом, а полярные молекулы имеют дипольный момент. Притяжение происходит между зарядами и полярностью молекул ионов, что приводит к образованию устойчивых структур и соединений. |
Роль межмолекулярного взаимодействия в химии заключается в:
- Формировании молекулярных соединений. Взаимодействие сил притяжения и отталкивания между атомами и молекулами определяет структуру и устойчивость молекул. Оно играет важную роль в образовании химических соединений и определении их физических и химических свойств.
- Определении свойств вещества. Межмолекулярные взаимодействия влияют на состояние вещества (твердое, жидкое или газообразное), температуру плавления и кипения, плотность, вязкость и другие физические свойства. Знание этих принципов позволяет понять и объяснить поведение материалов и их использование в различных областях науки и техники.
- Участии в химических реакциях. Межмолекулярные силы играют решающую роль в химических реакциях, таких как взаимодействие молекул в растворах, реакциях с обратимым образованием комплексов и многих других процессах. Понимание данных взаимодействий помогает предсказывать и оптимизировать реакции, а также разрабатывать новые материалы и лекарства.
Лондоновская дисперсия
Лондоновская дисперсия возникает из-за временного возникновения диполя в неполярной молекуле. Данное явление обусловлено квантово-механическими флуктуациями электронов в молекуле, повлекшими временное смещение электронной облака и возникновение дипольного момента.
Взаимодействие между молекулами при лондоновской дисперсии является слабым и носит временный характер. Однако, даже такие слабые взаимодействия могут оказывать значительное влияние на свойства вещества.
Особенностью лондоновской дисперсии является то, что она действует между любыми типами молекул, независимо от их полярности. Таким образом, дисперсионные силы способны взаимодействовать между неполярными и полярными молекулами, а также между полярными молекулами.
Лондоновская дисперсия имеет важное значение в химических реакциях и в формировании молекулярных соединений. Она также влияет на физические свойства вещества, такие как точка кипения, вязкость и теплопроводность. Благодаря лондоновской дисперсии возможно образование агрегатных состояний вещества, таких как газы, жидкости и твердые вещества.
Диполь-дипольное взаимодействие
Диполем называется молекула, которая имеет положительный и отрицательный электрические заряды, разделенные некоторым расстоянием.
В диполь-дипольном взаимодействии положительный конец одной молекулы притягивает отрицательный конец другой молекулы, что вызывает образование притяжения между ними.
Такое взаимодействие проявляется в ряде химических соединений, например, воде (H2O). В молекуле воды атом кислорода обладает бóльшим электроотрицательностью, чем атомы водорода, что создает электрический диполь. Таким образом, молекулы воды могут взаимодействовать друг с другом за счет диполь-дипольного притяжения.
Диполь-дипольное взаимодействие имеет важное значение в химии, так как оно влияет на различные свойства вещества, такие как точка кипения, температурный коэффициент расширения, теплота испарения и т. д. Также диполь-дипольное взаимодействие может играть решающую роль в химических реакциях, участвуя в образовании или разрыве химических связей.
Для более наглядного представления диполь-дипольного взаимодействия можно использовать таблицу, в которой перечислены химические соединения, в которых такое взаимодействие наблюдается.
| Химическое соединение | Пример |
|---|---|
| Вода | H2O |
| Этиленгликоль | C2H6O2 |
| Аммиак | NH3 |
| Этанол | C2H5OH |
Таким образом, диполь-дипольное взаимодействие является одним из важных факторов в химии, определяющим множество свойств вещества и его поведение в различных условиях.
Ионно-дипольное взаимодействие
Основой ионно-дипольного взаимодействия является электростатическое притяжение между положительным ионом и отрицательным концом дипольной молекулы, или между отрицательным ионом и положительным концом дипольной молекулы.
Ионно-дипольные взаимодействия могут формироваться в различных системах. Например, в растворах электролитов, положительно заряженные ионы притягивают отрицательно заряженные дипольные молекулы, а отрицательно заряженные ионы — положительно заряженные дипольные молекулы.
Также ионно-дипольные взаимодействия могут играть важную роль в формировании межмолекулярных связей в кристаллических структурах. Например, в ионных кристаллах положительно заряженные ионы притягивают отрицательно заряженные дипольные молекулы вблизи себя, образуя прочные связи.
Ионно-дипольное взаимодействие также может быть важным фактором при растворении и реакции ионов в растворах. Например, в химических реакциях ионы могут образовывать ионно-дипольные комплексы с дипольными молекулами, что может влиять на скорость и направление реакции.
Ионно-дипольное взаимодействие имеет большое значение не только в химии, но и в биологии. Многие биологические процессы, такие как растворение лекарственных веществ, связывание молекул в белках и активация ферментов, основаны на ионно-дипольных взаимодействиях.
| Примеры ионно-дипольных взаимодействий | Описание |
|---|---|
| Растворение солей в воде | Положительно или отрицательно заряженные ионы взаимодействуют с дипольными молекулами воды |
| Связывание ионов в белках | Ионы могут вступать в ионно-дипольные взаимодействия с дипольными группами в аминокислотных остатках белков |
| Формирование комплексов между ионами и органическими соединениями | Ионы могут образовывать стабильные комплексы с органическими молекулами, например, в процессе катализа реакций |
В целом, ионно-дипольное взаимодействие является важным фактором, определяющим множество химических и биологических свойств вещества. Понимание этих взаимодействий позволяет более глубоко понять и объяснить различные процессы, происходящие в химических системах.
Видео:Силы Ван-дер-Ваальса (видео 1) | Силы межмолекулярного взаимодействия | ХимияСкачать

Роль межмолекулярного взаимодействия в химии
Одним из основных результатов межмолекулярного взаимодействия является формирование молекулярных соединений. Когда молекулы сходятся друг к другу, они образуют более сложные структуры с новыми свойствами. Это является основой для образования различных химических соединений и реакций.
Межмолекулярное взаимодействие также играет роль в определении свойств вещества. Взаимные силы между молекулами влияют на плотность, температуру плавления и кипения, растворимость и другие характеристики вещества. Например, сильные силы взаимодействия между молекулами делают вещество более плотным и имеющим высокие температуры плавления и кипения.
Различные формы межмолекулярного взаимодействия имеют различную силу и влияют на свойства вещества по-разному. Лондоновская дисперссия, диполь-дипольное взаимодействие и ионно-дипольное взаимодействие — это основные механизмы взаимодействия между молекулами.
В конечном счете, межмолекулярное взаимодействие является ключевым аспектом в понимании и прогнозировании химических процессов. Благодаря его роли, мы можем объяснить, почему определенные вещества обладают определенными свойствами и как они могут взаимодействовать друг с другом.
Таким образом, изучение и понимание межмолекулярного взаимодействия является необходимым для химиков, чтобы улучшить наши знания о свойствах и поведении веществ и использовать их в различных областях химии, включая синтез новых соединений, разработку материалов и решение множества прикладных задач.
Роль межмолекулярного взаимодействия в химии
Межмолекулярное взаимодействие играет важную роль в химии и влияет на различные аспекты вещества. Оно определяет структуру и свойства молекул, а также влияет на их химические реакции.
Одним из основных проявлений межмолекулярного взаимодействия является формирование молекулярных соединений. Молекулы различных веществ могут взаимодействовать друг с другом, образуя новые соединения с уникальными свойствами. Например, вода состоит из молекул, которые взаимодействуют между собой с помощью водородных связей, что делает воду жидкостью при комнатной температуре и позволяет ей обладать высокой теплоемкостью.
Межмолекулярное взаимодействие также играет роль в определении свойств вещества. Силы взаимодействия молекул могут определять такие свойства, как температура плавления и кипения, плотность, вязкость и т. д. Например, межмолекулярные силы взаимодействия определяют температуру, при которой вещество переходит из жидкой фазы в газовую или твердую.
Кроме того, межмолекулярное взаимодействие играет роль в химических реакциях. Некоторые реакции между молекулами происходят благодаря взаимодействию различных сил. Например, растворение ионных реагентов в веществе происходит благодаря ионно-дипольным взаимодействиям, а образование межмолекулярных связей в органических реакциях происходит в результате диполь-дипольного взаимодействия.
В целом, межмолекулярное взаимодействие является фундаментальным понятием в химии и играет ключевую роль в понимании и объяснении различных химических явлений и свойств вещества. Изучение сил межмолекулярного взаимодействия позволяет более глубоко понять структуру и поведение молекул, что важно для развития новых материалов и применения химии в различных отраслях науки и техники.
Определение свойств вещества
Межмолекулярное взаимодействие играет важную роль в определении свойств вещества. Взаимодействие между молекулами определяет такие характеристики, как температура плавления, теплота испарения, плотность и скорость химической реакции.
Одним из основных принципов межмолекулярного взаимодействия является лондоновская дисперссия. Это слабое притяжение между неполярными молекулами, вызванное временными изменениями в распределении электронной плотности. Лондоновская дисперссия может приводить к образованию молекулярных соединений и влиять на их физические свойства.
Диполь-дипольное взаимодействие — еще один важный тип межмолекулярного взаимодействия. Оно возникает между полярными молекулами, у которых есть разделение зарядов. Диполь-дипольное взаимодействие может влиять на температурный диапазон плавления и кипения молекулярных соединений.
Ионно-дипольное взаимодействие включает взаимодействие положительно заряженных ионов с полярными молекулами. Этот тип взаимодействия играет важную роль в растворении ионных соединений и определяет их растворимость и химические свойства.
Межмолекулярное взаимодействие также влияет на процессы химических реакций. Оно может определять скорость реакции, стабильность продуктов реакции и возможность их образования. К примеру, сильные межмолекулярные силы могут замедлять реакции и увеличивать энергию активации.
Все эти принципы межмолекулярного взаимодействия позволяют учитывать влияние молекулярной структуры на свойства вещества. Исследование межмолекулярных взаимодействий является важной частью химической науки и позволяет понять и объяснить множество явлений в химии и физике.
9. Химическиe реакции
Межмолекулярные взаимодействия играют важную роль в химических реакциях. Например, диполь-дипольное взаимодействие между положительно и отрицательно заряженными частями молекул может способствовать их притяжению и образованию химических связей.
Также ионно-дипольное взаимодействие может быть ответственно за осуществление некоторых реакций, где ионы притягиваются к полярным группам молекулы. Это может быть важно, например, при растворении солей в воде или реакциях с использованием ионных реагентов.
Межмолекулярные взаимодействия также определяют скорость химических реакций. Если молекулы реакционных веществ плохо соединены друг с другом, это может привести к замедлению реакции. Если же молекулярные соединения обладают высокой взаимной притяжимостью, реакция может протекать быстрее.
Таким образом, межмолекулярные взаимодействия играют важную роль в химических реакциях, определяя их возможность, скорость и характер протекания. Понимание этих взаимодействий позволяет более глубоко изучать и объяснять химические процессы в мире окружающих нас веществ.
💡 Видео
Водородная связь. 10 класс.Скачать

Растворимость органических соединений (видео 6) | Силы межмолекулярного взаимодействия | ХимияСкачать

Растворимость и межмолекулярные связи (видео 2) | Силы межмолекулярного взаимодействия | ХимияСкачать

Электроотрицательность и межмолекулярные взаимодействия (видео 12) | Химия. ВведениеСкачать

Межмолекулярные взаимодействия: скрытые силы, управляющие веществомСкачать

Силы взаимодействия молекул. 10 класс.Скачать

Тема 9. Межмолекулярное взаимодействие и водородная связьСкачать

1 3 Водородная связь Ван дер Ваальсовы силыСкачать

Водородная связь. Межмолекулярная и внутримолекулярнаяСкачать

Капиллярный эффект.Мениск (видео 4) | Силы межмолекулярного взаимодействия | ХимияСкачать

Межмолекулярное взаимодействие. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Точки кипения органических соединений (видео 5)| Силы межмолекулярного взаимодействия | ХимияСкачать

Слабое взаимодействие | 4 фундаментальных взаимодействияСкачать

Урок 83. Межмолекулярные взаимодействия.Скачать
ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

ЭТО НУЖНО ЗНАТЬ — Химия с нуля, Основные Химические ПонятияСкачать

