Электронная оболочка атома — это внешняя часть атома, состоящая из электронов, которые движутся по орбитам вокруг ядра. Строение электронной оболочки имеет огромное значение для понимания химических свойств веществ и процессов, происходящих в молекулах.
Атом состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, которая включает в себя электроны. Электроны размещаются в оболочках, которые называются энергетическими уровнями. Каждый энергетический уровень может содержать определенное количество электронов.
Функции электронной оболочки заключаются в обеспечении химической активности атомов, их способности взаимодействовать с другими атомами и образовывать соединения. Электроны в электронной оболочке участвуют в химических реакциях, образуя химические связи с электронами других атомов.
Строение электронной оболочки определяется расположением энергетических уровней и количеством электронов на каждом уровне. Обычно электроны заполняют уровни начиная с ближайшего к ядру и заканчивая наиболее удаленным. Уровни могут содержать от одного до восьми электронов.
Видео:СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Строение электронной оболочки атома
Строение электронной оболочки атома включает в себя электроны, которые движутся по определенным орбитам вокруг ядра. Электроны образуют различные энергетические уровни или квантовые оболочки.
Каждая электронная оболочка включает в себя несколько подуровней, которые имеют различные формы и ориентации в пространстве. На каждом подуровне может находиться определенное количество электронов.
Распределение электронов в атоме происходит в соответствии с принципом заполнения электронных оболочек. Сначала заполняются оболочки с наименьшей энергией, а затем последовательно заполняются оболочки с более высокой энергией.
Функции электронной оболочки включают определение химических свойств атомов. Электроны находящиеся на внешней оболочке, называемой валентной оболочкой, играют ключевую роль в процессе химических реакций. Они образуют химические связи с другими атомами и могут участвовать в обмене электронами.
В итоге, строение электронной оболочки атома является основой для понимания его химических свойств и взаимодействий с другими атомами. Изучение электронной оболочки и распределения электронов в атоме позволяет понять многое о строении вещества и процессах химических реакций.
Видео:8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Электроны в атоме
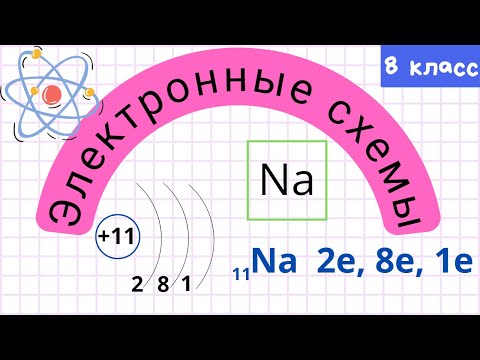
Пункт №4 относится к распределению электронов в атоме. У атома есть электронная оболочка, которая состоит из нескольких энергетических уровней, или квантовых оболочек. Каждая квантовая оболочка может содержать определенное количество электронов.
На первой квантовой оболочке может быть до 2 электронов, на второй — до 8, на третьей — до 18 и так далее. Каждый электрон в атоме занимает свое место в электронной оболочке, наполняя энергетические уровни снизу вверх, в соответствии с принципом заполнения электронных оболочек.
Чтобы понять, как электроны распределяются в атоме, можно использовать таблицу Менделеева. В ней электроны распределены по энергетическим уровням и подуровням. Например, первая квантовая оболочка имеет подуровни s. Вторая оболочка имеет подуровни s и p, третья — s, p и d, и так далее.
Каждый электрон имеет свой уникальный набор квантовых чисел, которые определяют его положение в атоме. Главное квантовое число определяет энергетический уровень, на котором находится электрон. Второе квантовое число определяет подуровень, на котором находится электрон. Магнитное квантовое число определяет ориентацию электрона в пространстве, а спиновое квантовое число определяет направление его спина.
Распределение электронов в атоме имеет важное значение для определения химических свойств атомов. Количество электронов во внешней оболочке атома, или валентных электронов, определяет химическую активность данного атома. Атомы стремятся заполнить свою внешнюю оболочку, чтобы достичь более стабильного состояния. Это объясняет возникновение химических связей между атомами и образование различных химических соединений.
| Квантовая оболочка | Количество электронов |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
Распределение электронов в атоме
Каждая оболочка может содержать несколько субуровней, обозначаемых буквами: s, p, d, f и так далее. На первой оболочке находится только один s-субуровень, на второй — два субуровня (s и p), на третьей — три (s, p и d), на четвертой — четыре (s, p, d и f) и так далее.
Каждый субуровень может содержать определенное количество электронов. Субуровень s способен вместить 2 электрона, субуровень p — 6 электронов, d — 10 электронов и f — 14 электронов.
При заполнении оболочек применяется принцип заполнения, согласно которому электроны заполняют сначала наименее энергетически выгодные оболочки и субуровни. Для заполнения субуровней применяется правило Хунда: электроны заполняют сначала субуровни с наименьшим расстоянием до ядра, а затем заполняют субуровни с наибольшим значением магнитного квантового числа.
Распределение электронов в атоме имеет огромное значение, так как определяет химические свойства атомов. Структура и заполнение электронных оболочек определяют, как атом будет взаимодействовать с другими атомами и формировать химические связи.
Квантовые оболочки и субуровни
Каждая квантовая оболочка состоит из субуровней, которые обозначаются буквами s, p, d и f. Субуровни характеризуют форму орбитали, на которой могут находиться электроны. Субуровень s – сферическая орбиталь, субуровень p – орбиталь формы шестиугольной призмы, субуровень d – орбиталь формы комплексной фигуры.
Принцип заполнения электронных оболочек определяет порядок заполнения субуровней электронами. Сначала заполняются субуровни меньшей энергии, затем – более высокой энергии. Стандартный порядок заполнения субуровней: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p и т.д.
В результате принципа заполнения электронных оболочек каждая оболочка может содержать определенное количество электронов. Внешняя оболочка, называемая валентной оболочкой, имеет наибольший возможный номер, поэтому именно она играет основную роль в определении химических свойств атомов и их взаимодействий с другими атомами.
Принцип заполнения электронных оболочек
Согласно принципу заполнения, электроны в атоме заполняют энергетические уровни в порядке возрастания их энергии. Первыми заполняются оболочки с наименьшей энергией, а последними — оболочки с наибольшей энергией. Каждая оболочка может содержать определенное количество электронов.
Как только одна оболочка полностью заполняется электронами, начинается заполнение следующей оболочки. При этом оболочка более высокой энергии может быть заполнена только после заполнения всех более низких энергетических уровней.
Принцип заполнения электронных оболочек объясняет распределение электронов в атоме и определяет его химические свойства. Знание порядка заполнения энергетических уровней позволяет предсказывать электронную конфигурацию и химические свойства всех элементов таблицы Менделеева.
Принцип заполнения электронных оболочек также помогает понять, как образуются связи между атомами в молекулах. Заполнение электронных оболочек определяет возможность атомов образовывать химические связи, а также их устойчивость.
Например, атомы с не заполненными оболочками могут образовывать связи с другими атомами путем обмена или совместного использования электронов, чтобы достичь стабильной электронной конфигурации.
Таким образом, принцип заполнения электронных оболочек является ключевым для понимания строения и функций электронной оболочки атома, а также определения его химических свойств.
Видео:БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Функции электронной оболочки
Одной из функций электронной оболочки является создание электростатического поля, которое взаимодействует с другими атомами. Это влияет на химические связи между атомами и обуславливает возможность образования химических соединений.
Электроны в электронной оболочке также определяют электронную конфигурацию атома, которая в свою очередь определяет его химические свойства. Количество валентных электронов, то есть электронов на последней заполненной оболочке, определяет готовность атома образовывать связи с другими атомами и участвовать в химических реакциях.
Образование химических связей — еще одна функция электронной оболочки. Электроны могут перемещаться или обменяться между атомами, создавая химические связи и образуя структуру соединений. Количество и тип химических связей, которые может образовать атом, зависит от его электронной конфигурации.
Электронная оболочка также участвует в определении электронной плотности атома. Это важный параметр, который оказывает влияние на различные физические свойства вещества, такие как проводимость, плотность, теплопроводность и т.д.
Кроме того, электронная оболочка может абсорбировать и испускать энергию в виде электромагнитного излучения, что определяет химические и физические свойства атомов и молекул.
Важно отметить, что функции электронной оболочки весьма сложны и взаимосвязаны. Их понимание помогает объяснить различные явления и процессы в химии и физике и является основой для развития новых материалов и технологий.
Определение химических свойств атомов
На химические свойства атомов влияет и расположение электронов внутри оболочки. Если электроны занимают энергетически более высокие уровни или субуровни, атом будет более реактивным и склонным к образованию химических соединений. Это объясняется тем, что электроны на более высоких уровнях находятся на большем расстоянии от ядра и слабее удерживаются электростатическим притяжением.
Химические свойства атома также зависят от спина электронов — их внутреннего магнитного момента. Электроны могут иметь спин «вверх» или «вниз», что определяет возможность образования химических связей с атомами других элементов.
Знание химических свойств атомов позволяет предсказывать и объяснять их реактивность, способность образовывать химические соединения и участвовать в химических реакциях. Это основа для понимания химической реакционной способности веществ и основа для разработки новых материалов и технологий.
📽️ Видео
Энергетические уровни атома (видео 6) | Квантовая физика | ФизикаСкачать

5. Распределение электронов в атомах. Энергетические уровни. Типы орбиталей.Скачать

Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

ХИМИЯ строение атома и СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК атомов 8 классСкачать

Энергетические уровни. 8 класс.Скачать

Строение электронных оболочек атома. Урок 18. Химия 8 классСкачать
Квантовые числа. Принцип Паули, правило Гунда (Хунда) и правило Клечковского. 2 часть. 10 класс.Скачать

Строение атома и электронные орбиталиСкачать

ХИМИЯ ПРОСТО — Электронная конфигурация атомаСкачать

Движение электронов в атоме. 1 часть. 8 класс.Скачать

Электронные конфигурации | Химия ЕГЭ | УмскулСкачать

52. Электронное строение атома (часть 1)Скачать

11 класс.Элементы 4 периода.Электронные формулы.Скачать

Квантовые числа. 1 часть. 10 класс.Скачать

11. Строение атома. Квантовые числаСкачать

Как решать 1 задание из ЕГЭ по химии "Электронная конфигурация атома"Скачать

СТАРТ КУРСА «ХимФак 2023» | 1 урок | Строение атома | Екатерина Строганова | 100балльный репетиторСкачать

