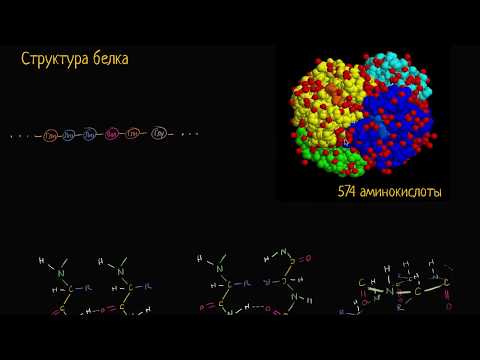
Связи, обеспечивающие удержание аминокислот в полипептиде, играют важную роль в структуре и функционировании белков. Белки являются основными строительными блоками всех живых организмов и выполняют различные функции, такие как транспорт молекул, катализ реакций, защита от инфекций и многие другие.
Связи в полипептиде формируются между аминокислотами, которые являются основными составляющими белков. Существует несколько видов связей, которые обеспечивают удержание аминокислот в полипептиде. Одной из наиболее важных является пептидная связь, которая образуется между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты.
Кроме пептидных связей, в полипептидах также могут формироваться другие типы связей, такие как гидрофобные взаимодействия, ионные связи и водородные связи. Гидрофобные взаимодействия возникают между гидрофобными остатками аминокислот, которые стремятся уйти от воды. Ионные связи образуются между заряженными остатками аминокислот, а водородные связи — между водородной группой одной аминокислоты и электроотрицательным атомом другой аминокислоты.
Все эти типы связей совместно обеспечивают удержание аминокислот в полипептиде и определяют его трехмерную структуру. Трехмерная структура полипептида имеет важное значение для его функционирования, так как определяет взаимодействие с другими молекулами и возможность выполнения конкретной функции в организме.
- Создание связей для удержания аминокислот в полипептиде
- Пептидная связь: ключевой элемент структуры
- Роль пептидной связи в образовании полипептида
- Механизм формирования пептидной связи
- Устойчивость пептидной связи: факторы, влияющие на ее прочность
- Водородные связи: силы, удерживающие структуру
- Влияние водородных связей на стабильность полипептидной цепи
- Особенности водородных связей между аминокислотами
- Взаимодействие водородной связи с другими типами связей
- 🎦 Видео
Видео:Пептидная связь. Образование пептидной связи. Запись структурной формулы пептида.Скачать

Создание связей для удержания аминокислот в полипептиде
Для образования связей между аминокислотами необходимо, чтобы химический группы на каждой аминокислоте реагировали между собой. Один из ключевых элементов, обеспечивающих создание связей, – карбоксильная группа (–COOH) каждой аминокислоты.
Карбоксильная группа аминокислоты содержит кислородный атом, который может образовать пептидную связь с аминогруппой (-NH2) другой аминокислоты. При этом осуществляется процесс депротонирования, в котором водородный ион переносится на молекулу аминокислоты, состоящую из аминогруппы и боковой цепи. В итоге образуется амидная группа (-CONH-), связывающая две аминокислоты и образующая пептидную связь.
Формирование связи между аминокислотами обусловлено наличием активных групп на их молекулах, которые совершают химическую реакцию объединения. В процессе синтеза белка, аминокислоты добавляются последовательно, и каждая новая аминокислота соединяется с предыдущей через пептидную связь.
За счет создания пептидных связей, молекулы аминокислот становятся связанными вместе и образуют полипептидную цепь. Эти связи обеспечивают устойчивость и прочность структуры полипептида.
Видео:Пептидная связь. 11 класс.Скачать

Пептидная связь: ключевой элемент структуры
Основная особенность пептидной связи заключается в том, что она является плоской и жесткой. Это происходит из-за резонансной гибридизации атомов углерода и азота, которые участвуют в образовании связи. За счет этой гибридизации, пептидная связь имеет частичный двойной характер. Это делает ее очень прочной и ковалентной. Пептидная связь обладает высокой устойчивостью и позволяет полипептидным цепям принимать различные пространственные конформации.
Пептидная связь также играет важную роль в стабильности полипептидной цепи. Благодаря особенностям формирования пептидной связи, она способна образовывать межцепные водородные связи, которые участвуют в формировании вторичных структур белков, таких как α-спираль и β-складки. Эти вторичные структуры обеспечивают дополнительную устойчивость и компактность полипептидной цепи.
Все эти свойства пептидной связи делают ее ключевым элементом в образовании и функционировании белков. Пептидные связи обеспечивают устойчивость и прочность структуры полипептида, а также определяют его функцию и способность взаимодействовать с другими молекулами. Поэтому понимание пептидной связи является фундаментальной задачей в изучении биохимии и белковой химии.
Роль пептидной связи в образовании полипептида
При образовании пептидной связи отщепляется молекула воды. В результате образуется диглицин или диаланин, в зависимости от аминокислот, которые участвуют в реакции. При последующем образовании новой пептидной связи между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты, происходит отщепление молекулы воды.
Образование пептидной связи позволяет объединять аминокислоты друг с другом в определенном порядке, образуя уникальную последовательность. Полипептидная цепь, образованная пептидными связями, является основой для образования белков.
Благодаря пептидной связи полипептидная цепь приобретает определенную пространственную конфигурацию. Пептидная связь создает прочное и стабильное основание для образования трехмерной структуры белка. Изменение последовательности аминокислот или нарушение пептидных связей может привести к нарушению структуры и функции белка.
Механизм формирования пептидной связи
Механизм формирования пептидной связи основывается на реакции конденсации, при которой аминогруппа реагирующей аминокислоты атакует карбоксильную группу другой аминокислоты. В результате этой реакции образуется пептидная связь, а молекула воды выделяется.
В реакции формирования пептидной связи участвуют две аминокислоты, причем аминогруппа одной из них образует соединение с карбоксильной группой другой, а аминогруппу второй аминокислоты можно считать высший акт в реакции.
Молекулы аминокислот активированы перед реакцией путем присоединения к ним молекулы ATP (аденозинтрифосфата). Под влиянием ферментов, называемых рибозомами, протекает сращивание между аминогруппой и карбоксильной группой. Этот процесс является важной стадией биосинтеза полипептидов, обеспечивающей связь аминокислот в цепи и дальнейшую формирование биологически активных структур и функций.
Таким образом, механизм формирования пептидной связи представляет собой сложную и тщательно регулируемую реакцию, которая определяет структуру и функцию полипептидных цепей. Понимание этого механизма является фундаментальным для изучения биологических процессов, связанных с синтезом и функционированием белков в организмах.
Устойчивость пептидной связи: факторы, влияющие на ее прочность
Пептидная связь играет ключевую роль в образовании полипептидов и белков. Её устойчивость и прочность определяются различными факторами, которые оказывают влияние на её формирование.
Основным фактором, влияющим на прочность пептидной связи, является длина полипептидной цепи. При увеличении числа аминокислот в цепи возрастает вероятность образования кросс-связей между разными участками цепи. Это способствует устойчивости связи и повышению её прочности.
Вторым фактором является конформация аминокислотных остатков, то есть их пространственное размещение в полипептидной цепи. Конформационные изменения могут приводить к подвижности атомов, что усиливает вероятность образования дополнительных связей и повышает устойчивость пептидной связи.
Третьим важным фактором является наличие взаимодействий с другими молекулами. Например, водородные связи между аминокислотными остатками могут усилить устойчивость пептидной связи, так как водородные связи являются сильными и способны удерживать структуру белка.
Необходимо также учесть, что пептидные связи подвержены воздействию физических и химических факторов, таких как температура, pH-среда и наличие органических растворителей. Эти факторы могут изменять стерические условия в области пептидной связи и оказывать влияние на её устойчивость и прочность.
В целом, устойчивость пептидной связи является важной характеристикой, которая определяет стабильность и прочность полипептидных цепей. Понимание факторов, влияющих на устойчивость пептидной связи, позволяет более глубоко изучить механизмы формирования и свойства белковых структур.
Видео:Белки - виды аминокислот, суточная потребностьСкачать

Водородные связи: силы, удерживающие структуру
Водородные связи играют важную роль в структуре белковых молекул и обеспечивают их стабильность. Эти силы действуют между атомами водорода и электронно-отрицательными атомами, такими как кислород, азот и фтор. Водородные связи обладают высокой прочностью и способны удерживать белковые структуры на месте.
Основными участниками водородной связи являются атом водорода (H) и электронно-отрицательный атом элемента (X). Атом водорода образует связь с атомом X через общие электроны, которые принадлежат и атому водорода, и атому X. Это создает пространственное взаимодействие между двумя молекулами и обеспечивает их удержание вместе.
Интересно, что водородные связи характеризуются не только силой, но и направленностью. Они могут образовываться как внутри молекулы, так и между различными молекулами. Внутримолекулярные водородные связи способствуют формированию сложных трехмерных структур белков, влияя на их складку и устойчивость.
Водородные связи также взаимодействуют с другими типами связей в белковых молекулах, такими как гидрофобные взаимодействия и ионные связи. Взаимодействие водородной связи с этими силами усиливает структурную целостность белков и обеспечивает им устойчивость.
В целом, водородные связи играют центральную роль в обеспечении удержания структуры белковых молекул. Они обладают высокой прочностью и устойчивостью, что позволяет белкам выполнять свои биологические функции. Понимание роли водородных связей в структуре полипептидов помогает расширить наши знания о биохимических процессах, происходящих в организмах живых существ.
Влияние водородных связей на стабильность полипептидной цепи
Водородная связь осуществляется за счет электростатического взаимодействия между отрицательно заряженным атомом кислорода или азота и положительно заряженным атомом водорода. Это взаимодействие является достаточно слабым, однако великое количество водородных связей в полипептиде обеспечивает его структурную устойчивость.
Водородные связи могут образовываться между различными частями полипептидной цепи, такими как аминогруппа и карбоксильная группа, а также между аминокислотами, расположенными на разных участках цепи. Это позволяет создать сложную трехмерную структуру полипептида, включая складки, спирали и листы.
Водородные связи сильно влияют на стабильность полипептидной цепи. Они обеспечивают силу внутренних взаимодействий между аминокислотами и удерживают их в правильном положении. Благодаря этому, полипептидная цепь может сохранять свою структуру даже в условиях изменений температуры или pH.
Кроме того, водородные связи влияют на взаимодействие полипептида с другими молекулами, такими как ферменты или антитела. Они способны образовывать комплексы с другими молекулами и участвовать в реакциях, необходимых для выполнения различных биологических функций.
Таким образом, водородные связи не только обеспечивают структурную устойчивость полипептидной цепи, но и играют ключевую роль в множестве биологических процессов.
Особенности водородных связей между аминокислотами
Водородные связи играют важную роль в удержании структуры полипептидов и обеспечивают их стабильность. Особенно важное значение имеют водородные связи между аминокислотами.
Когда пептидная связь образуется между двумя аминокислотами, атом водорода одного остатка аминокислоты может быть привлечен к атому кислорода другого остатка. Это взаимодействие происходит благодаря электронной плотности, создаваемой присутствием кислорода и водорода.
Важно отметить, что различные аминокислоты могут образовывать разные количество и типы водородных связей. Например, аминокислоты с боковыми цепями, содержащими доноры и акцепторы водорода, могут образовывать водородные связи с другими аминокислотами, содержащими схожие группы.
При формировании водородной связи между аминокислотами, доноры водорода, такие как кислород или нитроген, образуют водородные связи с акцепторами, такими как кислород, нитроген или сера. В результате образуется устойчивая структура, которая удерживает аминокислоты в полипептидной цепи.
| Аминокислота | Донор водорода | Акцептор водорода |
|---|---|---|
| Серин | Остаток -OH | Карбоксильная группа |
| Треонин | Остаток -OH | Карбоксильная группа |
| Глутамин | Остаток -NH2 | Карбоксильная группа |
| Аргинин | Гуанидиновая группа | Карбоксильная группа |
Приведенная таблица демонстрирует некоторые примеры аминокислот и соответствующие группы, которые могут участвовать в образовании водородных связей между ними. Водородные связи между аминокислотами обеспечивают дополнительную стабильность и порядок в полипептидной цепи.
Особенности водородных связей между аминокислотами играют важную роль в формировании и поддержании пространственной структуры белков, а также в их функционировании в организме.
Взаимодействие водородной связи с другими типами связей
Водородные связи играют важную роль в стабилизации полипептидной цепи за счет взаимодействия с другими типами связей.
Одним из ключевых элементов взаимодействия водородной связи является электростатическое взаимодействие между атомом водорода и атомами кислорода или азота. Эта связь создает дополнительные притягивающие силы, которые укрепляют структуру полипептида.
Особенно важна взаимосвязь водородной связи с пептидной связью. Атом водорода, связанный с аминокислотой в полипептиде, может образовать водородную связь с соседней аминокислотой. Это дополнительное взаимодействие значительно укрепляет полипептидную цепь и придает ей структурную стабильность.
Водородные связи также взаимодействуют с другими типами связей, такими как гидрофобные взаимодействия и ионные связи. Гидрофобные взаимодействия возникают между гидрофобными (нелипофильными) участками аминокислот, когда они оказываются в водной среде. Водородные связи между гидрофобными участками обеспечивают стабильность полипептидной цепи.
Также водородные связи могут взаимодействовать с ионными связями, которые возникают между заряженными аминокислотами. Водородные связи между заряженными аминокислотами обеспечивают стабилизацию полипептида, участвующего в формировании протеина.
Таким образом, водородные связи играют важную роль в удержании структуры полипептида. Они взаимодействуют с пептидной связью, гидрофобными взаимодействиями и ионными связями, укрепляя полипептидную цепь и придавая ей структурную стабильность.
🎦 Видео
Пептидная связьСкачать

ЕГЭ. Биология. 3.1. Белки: особенности строения. Аминокислоты, пептиды и полипептиды.Скачать

Белки | Биология 10 класс #8 | ИнфоурокСкачать

Аминокислоты, белки. Строение белков. Уровни организации белковой молекулы. Видеоурок по биологии 10Скачать

Что такое пептидная связь? Душкин объяснитСкачать

Синтез белка: трансляция | самое простое объяснениеСкачать
КАК ПОЯВЛЯЮТСЯ ПРОТЕИНЫ? Креационисты в ПАНИКЕ! | Биосинтез белка | Биохимия клеткиСкачать

ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ 1. Общая характеристика белков, пептидов и аминокислот.Скачать

ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ 2. Переваривание белков.Скачать

Роль белков и аминокислот в организме человекаСкачать

Путь от РНК к белкуСкачать
Анализ на аминокислоты в кровиСкачать

Движение пептидов в электрофоретическом поле при разных рН. Биохимия.Скачать

Колб В.А. Свойства синтезируемого рибосомой полипептида, ожидаемые и парадоксальныеСкачать

Аминокислоты. Полноценный и неполноценный белок. Питание вегетарианцев. Урок 6. Часть 2/7.Скачать

Биохимия Обмен отдельных аминокислотСкачать

Обзор структуры белка (видео 10) | Макромолекулы | БиологияСкачать