Связи, поддерживающие третичную структуру белка, играют важную роль в его функционировании и стабильности. Одним из типов связей, которые существуют между аминокислотными остатками внутри белка, являются перекрестные связи. Эти связи образуются между боковыми цепями аминокислот и могут быть ковалентными или нековалентными.
Ковалентные перекрестные связи, такие как дисульфидные мостики, образуются при окислительной конденсации двух цистеиновых остатков. Эти связи играют важную роль в укреплении третичной структуры белка и предотвращают его денатурацию.
Нековалентные перекрестные связи включают водородные связи и гидрофобные взаимодействия. Водородные связи образуются между гидрофильными атомами (чаще всего атомами кислорода и азота) и гидрофобными атомами (чаще всего атомами водорода) внутри белка. Эти связи способствуют укреплению третичной структуры и помогают белку сохранять свою форму и функции.
Гидрофобные взаимодействия возникают между гидрофобными (водонерастворимыми) группами аминокислотных остатков. Эти взаимодействия способствуют формированию гидрофобного ядра белка и его стабилизации. Они также играют важную роль в сворачивании белка в его биологически активную конформацию.
- Связи, поддерживающие третичную структуру белка:
- Перекрестные связи
- Роль в стабилизации структуры белка
- Механизм образования перекрестных связей в третичной структуре белка
- Водородные связи
- Влияние водородных связей на формирование пространственной конформации белка
- Взаимодействие с положительно заряженными группами аминокислот
- Гидрофобные взаимодействия: роль в формировании гидрофобного ядра
- Роль гидрофобных взаимодействий в формировании гидрофобного ядра
- 🔍 Видео
Видео:Третичная структура белка (видео 11) | Макромолекулы | БиологияСкачать

Связи, поддерживающие третичную структуру белка:
Одной из основных связей, поддерживающих третичную структуру белка, являются перекрестные связи, которые формируются между боковыми цепями аминокислот. Эти связи образуются благодаря ковалентным взаимодействиям, таким как дисульфидные мосты, которые соединяют две цистеиновые остатки. Перекрестные связи укрепляют белок, делая его более стабильным и устойчивым к внешним воздействиям.
Второй тип связей, играющий важную роль в поддержании третичной структуры белка, это водородные связи. Водородные связи возникают между электронно-акцепторными группами одной аминокислоты и электронно-донорными группами другой аминокислоты. Они сильно влияют на формирование пространственной конформации белка, помогая поддерживать его устойчивую третичную структуру.
Еще одним типом связей, обеспечивающих третичную структуру белка, являются гидрофобные взаимодействия. Эти взаимодействия происходят между гидрофобными боковыми цепями аминокислот, которые предпочитают находиться в водоотталкивающем окружении. Гидрофобные взаимодействия играют важную роль в формировании гидрофобного ядра белка, которое обеспечивает его стабильность и защищает его от взаимодействия с водой.
В целом, связи, поддерживающие третичную структуру белка, являются ключевыми для его правильного сложения и функционирования. Они взаимодействуют между собой, чтобы образовать устойчивую структуру, которая определяет свойства и активность белка. Понимание этих связей позволяет лучше понять белковую биологию и разрабатывать новые методы в области белковых технологий и медицины.
Видео:Третичная структура белкаСкачать
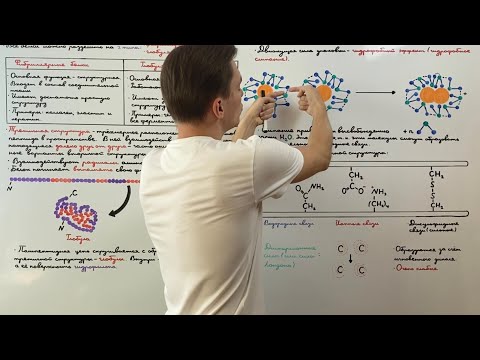
Перекрестные связи
Координационные перекрестные связи возникают, когда металлический ион вступает во взаимодействие с определенными атомами в белке. Это может быть атом серы, азота или кислорода. Координационные перекрестные связи могут играть важную роль в катализе реакций, связанных с белками.
Сольватные перекрестные связи возникают между белком и молекулами растворителя. Они могут быть образованы водородными связями или другими типами слабых взаимодействий. Сольватные перекрестные связи могут участвовать в поддержании устойчивости третичной структуры белка и взаимодействии с окружающей средой.
Ионные перекрестные связи возникают между положительно и отрицательно заряженными атомами или группами аминокислот. Они могут быть формированы между атомами кислорода и азота или между кислотными остатками и основными остатками. Ионные перекрестные связи играют важную роль в стабилизации структуры белка и могут быть ключевыми для его функционирования.
Роль в стабилизации структуры белка
Перекрестные связи, водородные связи и гидрофобные взаимодействия играют важную роль в стабилизации третичной структуры белка. Они обеспечивают прочность, устойчивость и правильную конформацию белковой молекулы.
Перекрестные связи, также известные как дисульфидные мостики, состоят из ковалентных связей между двумя атомами серы. Они играют ключевую роль в укреплении пространственной конформации белка, особенно в его складывании и образовании структурных доменов. Перекрестные связи образуются при окислении двух цистеиновых остатков, которые расположены рядом друг с другом в аминокислотной последовательности. Эти связи обеспечивают стабильность белка в условиях окружающей среды.
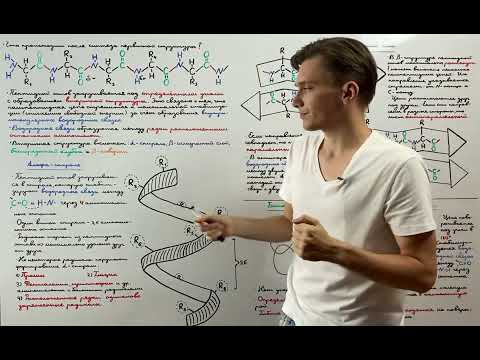
Водородные связи также сильно влияют на стабилизацию структуры белка. Они образуются между электронно-донорными и электронно-акцепторными группами аминокислот. Водородные связи играют важную роль в поддержании пространственной конформации белка, особенно в формировании α-спиральных и β-листовых структур. Благодаря водородным связям белок приобретает свою трехмерную структуру и устойчивость.
Гидрофобные взаимодействия также вносят значительный вклад в стабилизацию структуры белка. Они возникают между гидрофобными, или не полярными, аминокислотными остатками, которые стремятся исключить себя из взаимодействия с водой. Когда гидрофобные остатки сближаются, они образуют гидрофобное ядро, которое играет важнейшую роль в формировании и стабилизации третичной структуры белка. Гидрофобные взаимодействия помогают предотвратить полимеразу из перехода в гелий, что позволяет поддерживать устойчивость формы белка.
Механизм образования перекрестных связей в третичной структуре белка
Процесс начинается с окисления двух серных атомов, которые находятся в близком пространственном расположении внутри белковой цепи. Окисление происходит путем образования дисульфидной связи между двумя серами. Этот процесс включает реакцию между двумя молекулами цистеина и требует наличия окислителя, такого как молекулярный кислород.
Окисление цистеиновых остатков может произойти во время синтеза белка в клетке (внутриклеточное окисление) или внеклеточно, после выхода белка из клетки. Начав образовываться в доокисленном состоянии, перекрестные связи могут продолжиться и в полностью окисленном состоянии.
Однако механизм образования перекрестных связей не ограничивается только окислительными реакциями. Существуют и другие факторы, которые могут влиять на образование и стабильность этих связей, такие как pH среды и пристутствие кофакторов.
| Связь | Механизм образования |
|---|---|
| Перекрестные связи | Окисление цистеиновых остатков |
| Водородные связи | Взаимодействие водородных атомов |
| Гидрофобные взаимодействия | Взаимодействие гидрофобных участков |
В итоге, механизм образования перекрестных связей в третичной структуре белка является важным этапом в его формировании и стабилизации. Эти связи способны укрепить пространственную конформацию белка и сыграть роль в формировании его гидрофобного ядра.
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Водородные связи
Водородная связь образуется между водородной группой атома водорода и атомами элементов, обладающими высокой электроотрицательностью, такими как кислород и азот. Важными составляющими водородной связи являются донор водорода (атом, отдающий водород) и акцептор водорода (атом, принимающий водород).
Образование водородных связей зависит от электростатического притяжения между донором и акцептором. Водородные связи могут быть относительно слабыми, но вместе они обеспечивают значительную стабильность белковой структуры.
Водородные связи влияют на формирование пространственной конформации белков, так как ограничивают возможные конформации аминокислотных остатков в пространстве. Они также способны взаимодействовать с положительно заряженными группами аминокислот, участвуя в формировании межмолекулярных или внутримолекулярных связей.
В целом, водородные связи являются ключевыми элементами, обеспечивающими стабильность и пространственную организацию белковой структуры. Они играют важную роль во многих биологических процессах и являются объектом изучения в молекулярной биологии и биохимии.
Влияние водородных связей на формирование пространственной конформации белка
Водородные связи играют важную роль в формировании пространственной конформации белка. Эти связи образуются между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода или азота.
Водородные связи способны удерживать аминокислотные остатки в их оптимальных пространственных позициях, что обеспечивает стабильность третичной структуры белка. Они позволяют сохранять определенные углы и расстояния между атомами, что определяет свернутую 3D-форму белка.
В то же время, водородные связи гибки и могут образовываться и разрываться в ответ на изменение условий окружающей среды или взаимодействия с другими молекулами. Это позволяет белкам изменять свою конформацию и выполнять свои функции, такие как связывание субстрата или участие в каталитических реакциях.
Взаимодействие водородных связей с положительно заряженными группами аминокислот также играет важную роль в формировании пространственной конформации белка. Положительно заряженные аминокислоты, такие как лизин или аргинин, могут электростатически притягивать отрицательно заряженные группы и участвовать в образовании водородных связей.
Таким образом, водородные связи влияют на формирование пространственной конформации белка, обеспечивая его структурную стабильность и функциональность. Понимание этого взаимодействия является важным шагом в изучении белков и разработке новых методов для их модификации и применения в различных областях, включая фармацевтику и биотехнологию.
Взаимодействие с положительно заряженными группами аминокислот
Аминокислоты, из которых состоят белки, могут содержать положительно заряженные группы, такие как аминогруппы и группы гистидина. Эти положительные заряды могут взаимодействовать с отрицательно заряженными группами других аминокислот или с другими молекулами, что помогает устанавливать стабильность третичной структуры белка.
Взаимодействие положительно заряженных групп аминокислот с отрицательно заряженными группами может происходить через электростатические силы притяжения. В результате возникают сильные взаимодействия, которые способствуют формированию пространственной конформации белка.
Положительно заряженные группы аминокислот также могут взаимодействовать с другими молекулами, такими как нуклеиновые кислоты или другие белки. Эти взаимодействия могут играть роль в биологических процессах, таких как связывание ДНК или ферментативная активность.
В общем, взаимодействие с положительно заряженными группами аминокислот является важным фактором, определяющим структуру и функцию белка. Оно помогает устанавливать связи внутри молекулы, обеспечивая ее стабильность и способность выполнять свои функции в организме.
Видео:Структурная организация белков / БИОХИМИЯ белков, биохимия аминокислот, белки теплового шокаСкачать

Гидрофобные взаимодействия: роль в формировании гидрофобного ядра
Гидрофобные взаимодействия имеют большое значение в формировании гидрофобного ядра белка. Гидрофобное ядро представляет собой область внутри белка, где гидрофобные остатки аминокислот собираются вместе, укрываясь от контакта с водой.
Формирование гидрофобного ядра является критическим шагом при складывании белковой цепи в третичную структуру и может иметь существенное влияние на ее устойчивость. Гидрофобные взаимодействия помогают предотвратить нежелательное взаимодействие гидрофильных участков белка с водой, что способствует сохранению его структуры в гидрофобной среде.
Важным свойством гидрофобных взаимодействий является то, что они не требуют энергетически затратной связи с водой, так как гидрофобный остаток аминокислоты не диссоциирует в воду, а складывается в укрывающее его гидрофобное окружение. Это делает гидрофобные взаимодействия особенно стабильными и значительно уменьшает энергию, необходимую для поддержания трехмерной структуры белка.
Таким образом, гидрофобные взаимодействия играют важную роль в формировании и стабилизации третичной структуры белка, обеспечивая его функциональность и устойчивость в гидрофобной среде.
Роль гидрофобных взаимодействий в формировании гидрофобного ядра
В третичной структуре белка гидрофобные взаимодействия играют важную роль в формировании гидрофобного ядра. Гидрофобное ядро представляет собой участок белковой молекулы, где гидрофобные (неполярные) аминокислоты располагаются близко друг к другу, образуя внутренний гидрофобный карман или кластер.
Гидрофобные взаимодействия основаны на тенденции гидрофобных групп отталкиваться от воды и постепенно сближаться между собой вблизи гидрофобного ядра. Это явление называется гидрофобным эффектом.
Гидрофобное ядро имеет важное значение для стабилизации третичной структуры белка. Гидрофобные взаимодействия помогают свернуть белковую цепь в компактную трехмерную структуру, исключая свободное пространство внутри молекулы, где вода может проникнуть. Таким образом, гидрофобные взаимодействия обеспечивают стабильность и устойчивость третичной структуры белка.
Кроме того, гидрофобное ядро также влияет на функционирование белка. Оно способствует образованию активного центра, где происходят химические реакции, связанные с каталитической активностью белка. Формирование гидрофобного ядра также может изменять пространственную конформацию белка, что влияет на его взаимодействие с другими молекулами и биологическую активность.
Важно отметить, что гидрофобные взаимодействия не являются единственными связями, поддерживающими третичную структуру белка, но играют существенную роль в формировании гидрофобного ядра и обеспечении его стабильности.
🔍 Видео
Вторичная структура белкаСкачать
Биосинтез белка за 3 минуты (даже меньше)Скачать

Биохимия. Конформация белков. Фолдинг белков.Скачать

Структуры белкаСкачать

Структура белковой молекулы. БиохимияСкачать

Как устроена первичная структура белка? Душкин объяснитСкачать

Структура белковСкачать

Четвертичная структура белкаСкачать

Биохимия. Лекция 2. Белки. Уровни организации белков. Функции белков.Скачать

Переваривание белка. БиохимияСкачать

Цитология. Лекция 21. Третичная и четвертичная структуры белкаСкачать

Биохимия. Лекция 3. Свойства и функции белков. Денатурация белков.Скачать

Как изобразить точечные структуры Льюиса (видео 7) | Химические связи и структура молекулСкачать

Трофические связи в биоценозе. Видеоурок по биологии 11 классСкачать

Структурная биология белка: обзор проблем и подходов - Павел ЯковлевСкачать

биохимия 2 лекция: вторичная, третичная, четвертичная структуры белкаСкачать

