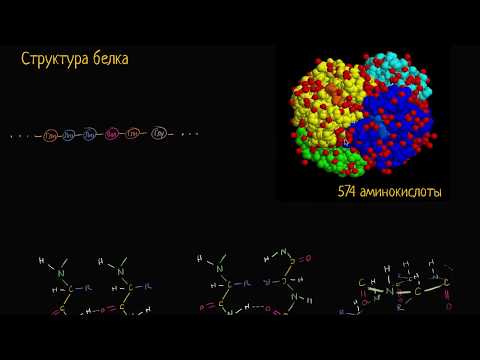
Белки являются одним из основных строительных блоков живых организмов. Их функциональное разнообразие определяется не только их секундарной и третичной структурой, но и первичной структурой – последовательностью аминокислот, которая через связи образует более сложные структуры. Изучение связей в первичной структуре белка играет важную роль в понимании его функций и влияет на разработку новых лекарственных препаратов и технологий.
Связи в первичной структуре белка – это последовательность аминокислот, которые соединены друг с другом пептидными связями. Эта последовательность определяется генетическим кодом, который в свою очередь закодирован в геноме организма. Каждая аминокислота в белке имеет свою уникальную химическую структуру, которая определяет ее свойства и функции.
Пептидные связи, образующиеся между соседними аминокислотами, являются основой первичной структуры белка. Эти связи характеризуются высокой стабильностью и особыми свойствами, которые обусловлены двумя атомами углерода и атомом кислорода, входящими в их состав. Изучение пептидных связей позволяет оценить стабильность белка, его способность к изменению и взаимодействию с другими молекулами.
Видео:Строение и функции белков.Скачать

Определение связей в первичной структуре белка
Аминокислотные остатки могут образовывать различные типы связей, как ковалентные, так и нековалентные. Ковалентные связи — это сильные и стабильные связи, образующиеся между аминокислотными остатками при образовании пептидной цепи белка. Нековалентные связи — это более слабые и динамические связи, которые могут образовываться между различными аминокислотными остатками и играют важную роль в стабильности и функционировании белка.
Ковалентные связи между аминокислотными остатками образуются при сшивке молекулы белка. Гидролиз пептидной связи приводит к разрушению белковой структуры. Основными ковалентными связями, участвующими в создании первичной структуры белка, являются пептидные связи.
Нековалентные связи между аминокислотными остатками в первичной структуре белка включают силы ван-дер-Ваальса, водородные связи, ионные связи и взаимодействия гидрофобного характера. Эти связи являются более слабыми и подвижными, что позволяет белку изменять свою конформацию и выполнять различные функции.
Определение связей в первичной структуре белка играет ключевую роль в понимании его функций. Знание типов и энергетических характеристик этих связей позволяет предсказывать и моделировать термодинамические и кинетические свойства белка, а также разрабатывать новые методы и инструменты для его исследования и применения.
Ковалентные связи
Основными ковалентными связями в первичной структуре белка являются пептидные связи. Пептидная связь образуется между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты. Эта связь определяет порядок аминокислот в цепочке белка.
Ковалентные связи также могут образовываться между атомами кислорода, серы и азота в аминокислотах. Эти связи имеют важное значение для структуры и функций белка. Например, ковалентные связи между серами в аминокислотах могут образовывать дисульфидные мостики, которые могут участвовать в создании третичной структуры белка.
Ковалентные связи в первичной структуре белка обладают высокой стабильностью и не легко разрушаются. Они играют важную роль в поддержании структуры и функций белка. Кроме того, ковалентные связи могут быть использованы в методах изучения первичной структуры белка, таких как секвенирование белков.
Нековалентные связи
Основными видами нековалентных связей являются:
- Водородные связи — образуются между положительным атомом водорода и отрицательно заряженным атомом или группой атомов, такими как кислород или азот. Водородные связи являются одними из наиболее значимых нековалентных связей в белках, так как они способны обеспечить хорошую стабильность структуры.
- Электростатические взаимодействия — возникают между положительно и отрицательно заряженными атомами или группами атомов. Они зависят от расстояния между заряженными частицами и их зарядов. Электростатические взаимодействия также могут оказывать значительное влияние на структуру и функции белка.
- Гидрофобные взаимодействия — возникают между гидрофобными (водоотталкивающими) участками белка. Они основаны на стремлении гидрофобных участков сворачиваться внутрь белковой структуры, чтобы минимизировать контакт с водой. Гидрофобные взаимодействия играют роль в формировании гидрофобного ядра белка и в определении его структуры.
- Вани-дер-Ваальсовы взаимодействия — возникают между неполярными атомами или молекулами. Они основаны на временных изменениях электронного облака атомов и молекул, что приводит к появлению временных диполей и возможности взаимодействия друг с другом. Вани-дер-Ваальсовы взаимодействия играют важную роль в определении структуры белков и обеспечивают их стабильность.
Нековалентные связи в первичной структуре белка обеспечивают его трехмерную структуру, стабильность, функциональность и взаимодействие с другими молекулами. Понимание роли и влияния нековалентных связей является важным для биохимического исследования белков и разработки новых лекарственных препаратов.
Видео:Первичная структура белкаСкачать

Роль связей в первичной структуре белка
Связи в первичной структуре белка играют важную роль в определении его функций. Первичная структура белка представляет собой последовательность аминокислот, связанных между собой различными типами связей.
Связи в первичной структуре белка могут быть как ковалентными, так и нековалентными. Ковалентные связи представляют собой прочные химические связи между атомами аминокислот, которые обеспечивают устойчивость структуры белка. Нековалентные связи, такие как водородные связи, ионные связи и ван-дер-ваальсовы взаимодействия, обладают более слабой силой и обеспечивают более гибкую структуру белка.
Разнообразие связей в первичной структуре белка определяет его уникальные свойства и функции. Связи между аминокислотами влияют на стабильность белка, его способность сворачиваться в определенную трехмерную структуру и взаимодействовать с другими молекулами.
Аминокислотные связи играют особую роль в функционировании белков. Они определяют специфичность белка, его способность распознавать и связываться с целевыми молекулами. Разные комбинации аминокислотных связей обеспечивают различные функции белков, такие как катализ химических реакций, транспорт молекул, сигнализацию и структурную поддержку.
| Связь | Описание |
|---|---|
| Ковалентные связи | Прочные химические связи между атомами аминокислот, обеспечивают устойчивость структуры белка |
| Нековалентные связи | Слабые взаимодействия между атомами аминокислот, обеспечивают гибкость структуры белка |
| Аминокислотные связи | Определяют специфичность и функции белков |
Методы изучения связей в первичной структуре белка включают секвенирование белков, которое позволяет определить порядок аминокислот в цепи. Это позволяет установить типы связей и их последовательность в белке.
Влияние на стабильность белка
Связи в первичной структуре белка играют важную роль в его стабильности. Уровень устойчивости белка определяется комплексным взаимодействием различных связей, которые образуются между аминокислотами.
Ковалентные связи, такие как пептидные связи, несут основную ответственность за строение и стабильность цепочки аминокислот в белке. Пептидные связи образуются путем соединения аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. Эти связи обеспечивают прочность и устойчивость структуры белка, а также позволяют ему взаимодействовать с другими молекулами и биологическими структурами.
Нековалентные связи, такие как водородные связи, гидрофобные взаимодействия и ионные связи, также влияют на стабильность белка. Водородные связи формируются между атомами водорода и электроотрицательными атомами аминокислот. Гидрофобные взаимодействия происходят между гидрофобными остатками, которые предпочитают находиться внутри белка, в отделенной гидрофильной среде. Ионные связи формируются между положительно и отрицательно заряженными остатками аминокислот. Все эти нековалентные связи помогают поддерживать трехмерную структуру белка и укрепляют его стабильность.
Влияние на стабильность белка важно для его функционирования в организме. Нестабильные белки могут легко изменять свою структуру или разрушаться под действием физических или химических факторов, что может привести к потере их функции. Стабильные белки, с другой стороны, легко сохраняют свою структуру и сохраняют способность взаимодействовать с другими молекулами и участвовать в биологических процессах.
Таким образом, связи в первичной структуре белка играют критическую роль в его стабильности. Ковалентные и нековалентные связи обеспечивают прочность и устойчивость структуры белка, а также позволяют ему выполнять свои функции в организме. Понимание влияния этих связей на стабильность белка является важным шагом в изучении его функций и разработке новых терапевтических подходов.
Аминокислотные связи и функции белков
Аминокислотные связи играют важную роль в первичной структуре белка и определяют его функции. В белках существуют различные типы аминокислотных связей, которые обеспечивают их стабильность и функциональность.
Уровень взаимодействия аминокислот определяется их химическими свойствами. Различные аминокислоты могут образовывать разные типы связей, включая пептидные связи, сульфидные мостики и водородные связи.
Пептидные связи образуются между карбоксильной группой одной аминокислоты и аминогруппой другой. Они являются основной структурной основой белков и обеспечивают их прочность и устойчивость.
Сульфидные мостики образуются между двумя цистеиновыми остатками путем окисления гидрофобных боковых цепей. Эти связи влияют на пространственную организацию белка и могут быть важными для его структуры и функции.
Водородные связи возникают между атомами водорода одной аминокислоты и атомами кислорода или азота другой аминокислоты. Они играют важную роль в формировании пространственной структуры белка и участвуют в его взаимодействиях с другими молекулами.
Аминокислотные связи напрямую связаны с функциями белков. Они могут определять их каталитическую активность, способность к связыванию с молекулами-лигандами, стабильность при различных условиях и многое другое.
Например, пептидные связи обеспечивают прочность структуры белка и его способность сохранять конформацию, необходимую для функции. Водородные связи могут способствовать связыванию молекул-лигандов и обеспечивать специфичность взаимодействия.
Изучение аминокислотных связей в первичной структуре белка осуществляется с использованием различных методов, включая секвенирование белков. Эти методы позволяют определить последовательность аминокислот в белке и изучить их взаимодействия и функции.
В целом, аминокислотные связи играют ключевую роль в определении функций белков. Их химические свойства и взаимодействия обеспечивают стабильность, форму и функцию белка, что делает их важными объектами изучения в биохимии и молекулярной биологии.
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Методы изучения связей в первичной структуре белка
Один из основных методов — секвенирование белков. Секвенирование позволяет определить последовательность аминокислот в белке, что в свою очередь позволяет выявить и изучить связи между ними. Существуют различные методы секвенирования, включая классический метод Эдмана и современные автоматические методы.
Еще одним методом является спектроскопия массового анализа. С помощью этого метода можно определить массу белка и его компонентов, а также изучить связи между ними. Спектроскопия массового анализа позволяет получить информацию о массе аминокислот, пептидов и других молекул, содержащихся в белке.
Другим методом изучения связей в первичной структуре белка является рентгеноструктурный анализ. Этот метод позволяет получить трехмерное представление структуры белка и выявить связи между аминокислотами. Рентгеноструктурный анализ основан на рассеянии рентгеновских лучей кристаллом белка, что позволяет определить его атомную структуру.
И наконец, одним из наиболее современных методов изучения связей в первичной структуре белка является метод ядерного магнитного резонанса (ЯМР). С помощью ЯМР можно изучать взаимодействия атомов внутри белка, включая связи между ними. Этот метод позволяет получить информацию о пространственной структуре молекулы и ее динамике.
Таким образом, методы изучения связей в первичной структуре белка играют важную роль в понимании его функций и взаимодействий с другими молекулами. Секвенирование, спектроскопия массового анализа, рентгеноструктурный анализ и ядерный магнитный резонанс — каждый из этих методов предоставляет уникальную информацию о связях в первичной структуре белка и способствует расширению наших знаний в этой области.
Секвенирование белков
Секвенирование белков может быть проведено с помощью различных техник и методов. Одним из основных методов секвенирования белков является метод Эдмана, который базируется на последовательном удалении аминокислотных остатков с N-конца белка. Этот метод позволяет определить последовательность до 50-70 аминокислот.
Еще одним методом секвенирования белков является метод масс-спектрометрии. Он позволяет определить массу каждой аминокислоты в белке и построить ее масс-спектр. Затем, с помощью специальных программ, происходит анализ масс-спектра и определение последовательности аминокислот в белке.
Также существует метод секвенирования белков на основе денатурации и гидролиза. При этом методе белок подвергается денатурации и превращается в цепочку аминокислот. Затем происходит гидролиз, где цепочка разбивается на отдельные аминокислоты. С помощью специальных методов анализируется соотношение аминокислот и определяется последовательность.
Секвенирование белков является неотъемлемой частью исследований в области биохимии и биологии. Оно позволяет не только определить последовательность аминокислот в белке, но и понять его функции, структуру и взаимодействия с другими молекулами. Это очень важно для дальнейшего изучения и применения белков в различных сферах, включая медицину, пищевую промышленность и биотехнологии.
📽️ Видео
Строение и уровни структурной организации белков. 10 класс.Скачать

Вторичная структура белкаСкачать
Структура белковСкачать

Биосинтез белка за 3 минуты (даже меньше)Скачать

Структуры белкаСкачать

Что такое фолдинг белков? Душкин объяснитСкачать

Как устроена первичная структура белка? Душкин объяснитСкачать

Белки. Их свойства и функции. 8 класс.Скачать

Биохимия. Лекция 2. Белки. Уровни организации белков. Функции белков.Скачать

Первичная и вторичная структура белка. ЕГЭ Биология. ЕГЭ 2021.Скачать

ТОП-10 функций белка | Биология | TutorOnlineСкачать

115. Первичная структура белкаСкачать

Третичная структура белкаСкачать
ДНК и РНКСкачать

Белки. Видеоурок 6. Биология 9 классСкачать

Структура белковой молекулы. БиохимияСкачать

Обзор структуры белка (видео 10) | Макромолекулы | БиологияСкачать