Валентность — одно из основных понятий в химии, которое определяет способность атомов образовывать химические связи. Она описывает число электронов, которое атом может принять, отдать или разделить в процессе образования химической связи. Валентность играет важную роль в понимании структуры и свойств молекул, а также в предсказании химических реакций.
Определение валентности основано на электронной конфигурации атомов. Она определяется числом электронов в внешнем электронном слое атома, который называется валентным слоем. Атомы стремятся заполнить свой валентный слой электронами путем образования связей с другими атомами.
Обычно валентность атома указывается с помощью числа, которое записывается справа от символа химического элемента. Если атом может образовать несколько типов связей, то валентность может быть представлена как диапазон чисел. Например, углерод имеет валентность 4, что означает, что он может образовывать четыре связи с другими атомами.
Видео:Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Что такое валентность?
Валентность определяется количеством электронов, которые атом может отдать или принять при образовании химической связи. Она может быть положительной или отрицательной, в зависимости от того, электроны отдаются или принимаются.
Определение валентность позволяет предсказывать типы и свойства химических соединений. Зная валентность атомов, можно точно определить степень окисления атома в соединении. Это важно для понимания реакций и свойств веществ.
Исторически понятие валентности было введено в химию Джорджем Бутли-Вольтером. Начиная с того времени, это понятие развивалось и уточнялось, обретая более точное определение в современной химии.
Валентность играет ключевую роль в принципах линейных связей, определяющих структуру и свойства соединений. Она также влияет на совместимость и стабильность веществ. Знание валентности позволяет предсказать реактивность и химические реакции соединений.
Определение степени окисления является одним из основополагающих понятий в химии и тесно связано с валентностью. Оно позволяет определить изменение валентности атомов в ходе химической реакции и дает представление о том, какие изменения происходят в структуре и свойствах вещества.
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Определение валентности
История понятия валентности берет свое начало в конце 19 века, когда ученые исследовали химические связи и стали понимать, что атомы имеют определенное количество электронов во внешней оболочке, которые могут быть использованы для образования связей. Так, валентность стала показателем количества электронов, которое может участвовать в химической реакции.
Современное определение валентности основано на концепции электронной оболочки атома. Валентность атома определяется как число связей, которое атом может образовать с другими атомами. Например, водородный атом имеет валентность 1, поскольку он может образовать одну связь, а кислородный атом имеет валентность 2, так как он может образовать две связи.
Значение валентности в химии заключается в том, что оно определяет способность атомов образовывать химические связи и участвовать в химических реакциях. Валентность помогает предсказывать поведение вещества и его реакционную способность, а также определяет структуру и свойства различных соединений. Например, связи с определенной валентностью могут быть более сильными и стабильными, в то время как связи с другой валентностью могут быть более реактивными и менее стабильными.
Принципы линейных связей определяют, какие атомы и в каком количестве могут образовывать связи между собой. Это помогает определить структуру молекулы и ее связи. Например, водород и кислород могут образовать связь, образуя молекулу воды H2O.
Совместимость и стабильность веществ также зависят от валентности. Если атомы имеют совместимую валентность, то они могут образовывать стабильные и прочные связи, что делает вещество стабильным и нереактивным. С другой стороны, если атомы имеют несовместимую валентность, то они могут образовывать менее стабильные и более реактивные связи, что делает вещество более реакционным и менее стабильным.
Реактивность и химические реакции также связаны с валентностью. Атомы с определенной валентностью могут образовывать связи с другими атомами, образуя новые вещества. Например, при соединении двух атомов водорода с одним атомом кислорода образуется молекула воды.
Историческая справка и развитие понятия
В то время было обнаружено, что атомы не могут образовывать произвольное количество связей, а имеют фиксированные значения валентности. Льюи предложил нумеровать эти значения, чтобы обозначить возможное количество связей, которые атом может образовать с другими атомами.
С течением времени понятие валентности развивалось и претерпевало изменения. Вначале валентность определялась исключительно количеством образованных связей, но позже стало понятно, что этот подход не полностью объясняет взаимодействие атомов в молекуле.
С развитием квантовой механики и открытием электронной структуры атомов стало ясно, что валентность также связана с количеством электронов, которые могут участвовать в образовании связи. Введение понятия валентностной связи, основанной на совместном использовании электронов, позволило более точно объяснить связывание атомов и образование молекул.
В современной химии валентность определяется как число связей, которые может образовать атом в рамках определенной химической структуры. Она также учитывает электронные конфигурации атомов и их возможности образования электронных пар, не принадлежащих только одному атому.
Определение валентности в современной химии
Валентность может быть положительной или отрицательной, в зависимости от того, отдает или принимает электроны атом. Валентность элемента также может быть переменной, если атом данного элемента способен образовывать соединения с различными степенями окисления.
Определение валентности в современной химии основано на электронной структуре атома. Количество электронов на внешнем энергетическом уровне атома определяет его валентность. Например, когда атом образует химическую связь, он может отдать или принять электроны так, чтобы достичь стабильной электронной конфигурации, заполненного или пустого энергетического уровня.
Валентность играет важную роль в химии, так как она позволяет предсказывать, какие химические соединения могут образовываться между элементами, основываясь на их валентности. Это помогает определить совместимость веществ, их стабильность и реактивность.
Принципы линейных связей также основаны на валентности элементов. Они указывают на то, что валентность элементов, образующих химическую связь, должна быть согласована, чтобы образовалось стабильное химическое соединение. Если валентности элементов не согласованы, возникают нестабильные соединения, которые могут развалиться или претерпеть химические реакции.
Валентность элементов также помогает определить степень окисления при химических реакциях. Степень окисления элемента определяет изменение электронной структуры элемента в результате химической реакции.
Таким образом, определение валентности в современной химии играет важную роль в понимании свойств веществ, их реакций и взаимодействий.
Видео:ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Значение валентности в химии
В химии понятие валентности играет важную роль при изучении соединений и реакций между веществами. Оно позволяет определить, сколько атомов одного элемента может объединяться с атомами другого элемента. Определение валентности основано на принципе линейных связей, согласно которому атомы стремятся установить стабильные связи с другими атомами путем передачи, получения или разделения электронов.
Значение валентности определяется количеством свободных электронов во внешней электронной оболочке атома. Чем больше свободных электронов, тем выше валентность атома. Например, у водорода валентность равна 1, так как он имеет один электрон во внешней оболочке, а у кислорода – 2, так как он имеет два свободных электрона.
Значение валентности играет важную роль в определении совместимости и стабильности веществ. Атомы с разными значениями валентности могут образовывать различные соединения, в которых одни атомы будут передавать или получать электроны от других атомов. Такие химические реакции могут приводить к образованию новых веществ.
| Элемент | Валентность |
|---|---|
| Водород | 1 |
| Кислород | 2 |
| Углерод | 4 |
| Хлор | 1 |
Таблица выше демонстрирует значения валентности некоторых элементов. Зная эти значения, можно предположить, какие соединения могут образоваться между ними. Например, водород и кислород могут образовывать воду (H2O), так как один атом водорода может связываться с двумя атомами кислорода, передавая свой электрон.
Валентность также имеет отношение к определению степени окисления вещества. Она позволяет определить, сколько электронов передается или получается при окислительно-восстановительных реакциях. Знание значений валентности элементов позволяет установить, сколько атомов того или иного элемента окислилось или восстановилось, что является важным для многочисленных химических процессов.
Видео:Ковалентная Неполярная Связь — Химическая связь // Химия 8 классСкачать

Принципы линейных связей
Принципы линейных связей играют важную роль в химии, определяя совместимость и стабильность веществ. Линейные связи возникают между атомами в химических соединениях, обеспечивая их устойчивость и сохранение определенного строения.
Одним из основных принципов линейных связей является правило октета. Согласно этому правилу, атомы стремятся заполнить свою внешнюю электронную оболочку восемью электронами, чтобы достичь более стабильного энергетического состояния. Для этого атомы могут образовывать различные типы связей: ионные, ковалентные или металлические.
В химических соединениях линейные связи могут иметь разные углы, определяющие их структуру. Например, одиночные связи образуются при угле 180 градусов, двойные связи – при угле 120 градусов, а тройные связи – при угле 109,5 градусов. Эти углы позволяют атомам занимать определенное положение в пространстве и образовывать устойчивые структуры соединений.
Принцип линейных связей также определяет химическую реактивность веществ. Устойчивые соединения с линейными связями имеют меньшую склонность к реакциям, тогда как нестабильные соединения, в которых линейные связи нарушены, могут проявлять высокую реактивность и участвовать в химических превращениях.
Важно отметить, что принципы линейных связей не только определяют форму и структуру веществ, но и имеют практическое применение. Благодаря пониманию этих принципов, химики могут предсказывать свойства и поведение химических соединений, а также разрабатывать новые материалы с определенными характеристиками.
Совместимость и стабильность веществ
Совместимость веществ можно оценить на основе их реактивности и степени окисления. Вещества с схожими электрохимическими свойствами и степенью окисления обычно совместимы, поскольку их реакции обычно происходят относительно плавно и безопасно. Напротив, вещества с различной степенью окисления или сильно отличающимся электрохимическими свойствами могут быть несовместимыми и вызывать неожиданные и опасные реакции.
Стабильность вещества также играет важную роль. Стабильные вещества обычно обладают меньшей склонностью к разложению или реакциям, чем нестабильные. Поэтому стабильность вещества является признаком его способности сохранять свои химические свойства в течение длительного времени.
Для определения стабильности и совместимости вещества могут быть использованы различные методы и эксперименты. Например, проведение тепловых и химических анализов, а также изучение результатов реакции между различными веществами.
Знание о совместимости и стабильности веществ играет важную роль в различных областях химии, таких как фармакология, пищевая промышленность, аграрные науки и другие. Оно позволяет предсказывать реакции веществ и избегать нежелательных последствий, таких как отравления, взрывы или пожары.
Таким образом, понимание совместимости и стабильности веществ является важным для безопасной и эффективной работы в области химии и позволяет изучать, контролировать и применять различные химические реакции в широком спектре промышленных и научных областей.
Реактивность и химические реакции
Реактивность вещества зависит от его структуры и наличия активных функциональных групп. Вещества с высокой реактивностью имеют неустойчивые связи, что позволяет им легко участвовать в химических реакциях. Например, активные металлы, такие как натрий или калий, реагируют с водой, образуя гидроксид и выделяя водород.
Химическая реакция – это процесс, в котором происходят перестройки атомов и молекул вещества, приводящие к образованию новых веществ. Реакции происходят при наличии реагентов, которые инициируют изменения, и продуктов, которые образуются в результате реакции.
Реакции могут происходить с различным уровнем интенсивности и скорости. Некоторые реакции могут проходить мгновенно, в то время как другие могут занимать много времени. Кинетические характеристики реакций определяются множеством факторов, таких как температура, концентрация реагентов, физическое состояние, катализаторы и давление.
Реактивность и химические реакции являются ключевыми понятиями в химии и имеют широкое применение в различных областях науки и технологии. Они позволяют управлять и контролировать химические процессы, создавать новые вещества и материалы, а также изучать и понимать основные законы и принципы химии.
Реактивность – это неотъемлемый компонент химических исследований и применений, и понимание ее основных принципов является важным для практического применения химии в разных сферах жизни, будь то производство, экология или медицина.
Видео:ВАЛЕНТНОСТЬ | Как определить валентность | Как составить химическую формулу по валентностиСкачать

Определение степени окисления
Степень окисления рассчитывается путем определения изменения заряда, которое происходит в атоме или ионе при образовании химического соединения. Она может быть положительной, отрицательной или равной нулю, в зависимости от того, получает или отдает электроны атом или ион.
Степень окисления обычно обозначается римскими цифрами, после знака плюс или минус. Положительная степень окисления указывает на окислительные свойства вещества, то есть его способность принимать электроны. Отрицательная степень окисления указывает на вещество, которое может отдавать электроны и иметь восстановительные свойства. Степень окисления равна нулю, когда вещество не изменяет своего заряда или не обладает ни окислительными, ни восстановительными свойствами.
Определение степени окисления является ключевым шагом при анализе и понимании реакций, которые происходят в химических системах. Она позволяет определить, какие элементы находятся в окисленном или восстановленном состоянии, и какие реакции будут происходить при взаимодействии разных веществ.
Знание степени окисления позволяет прогнозировать результаты химических реакций, а также указывает на способность вещества вступать в различные химические связи и формировать стабильные соединения. Это имеет практическое значение при разработке новых материалов, лекарственных препаратов, а также в промышленности и энергетике.
🔍 Видео
Валентность. Учимся определять валентность элементов по формуламСкачать

Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

Ковалентная связь. 8 класс.Скачать
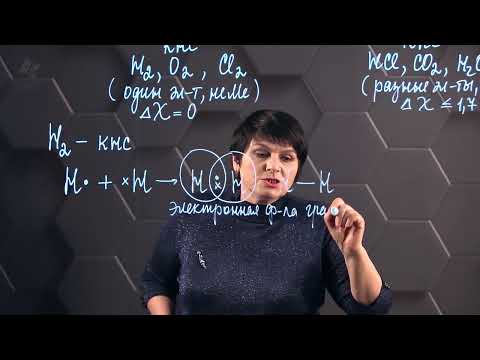
Валентность химических элементов. Урок 10. Химия 7 класс.Скачать

Валентные возможности атома. Метод валентных связей (МВС).Скачать

8 класс.Химическая связь.Скачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Эта САМАЯ ВАЖНАЯ тема в Химии. Что нужно знать про ВАЛЕНТНОСТЬ? (Химия для начинающих)Скачать

Математика это не ИсламСкачать

1. Валентность. урок 1. Электронная оболочкаСкачать
8 класс. Валентность. Бинарные соединения. Составление формул по валентности.Скачать

57. Механизмы образования ковалентной связиСкачать

Удалили с экзамена ОГЭ Устное Собеседование shorts #shortsСкачать

