Белок — это один из основных строительных блоков организмов, играющий ключевую роль в жизнедеятельности. Вторичная структура белка является важным компонентом его пространственной организации. Она определяется упорядоченным пространственным расположением аминокислотных остатков в молекуле и образует основу для третичной структуры белка.
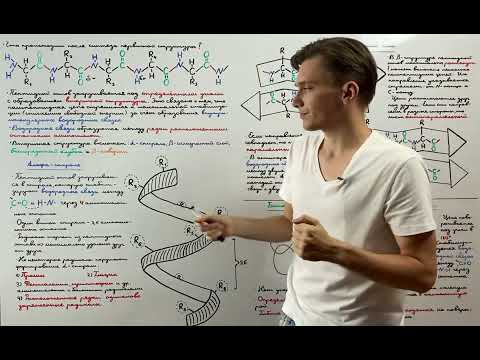
Главными типами вторичной структуры белка являются α-спираль и β-складка. В α-спирали аминокислоты связаны между собой через водородные связи, образуя спиральную форму. В β-складке аминокислотные остатки связаны друг с другом более сложными структурами, образующими параллельные или антипараллельные цепочки.
Химическая связь играет важную роль в формировании вторичной структуры белка. Основным типом химической связи, отвечающей за стабильность и прочность вторичной структуры, является водородная связь. Водородная связь образуется между гидрогенным атомом одной аминокислоты и кислородным, азотным или серным атомом другой аминокислоты, находящейся на пяти или четырех положенных на расстоянии аминокислотных остатках.
Видео:Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Вторичная структура белка
Наиболее распространенными формами вторичной структуры белка являются альфа-спираль (алфа-геликс) и бета-складка (бета-лист). Альфа-геликс характеризуется спиральным сворачиванием цепи, образуя стержень, в котором проводится спиральный виток. Бета-лист представляет собой «складку» или «плиссе» белковой цепи.
Вторичная структура белка оказывает значительное влияние на его физико-химические свойства и функциональную активность. Она обеспечивает прочность и устойчивость белковой структуры, а также определяет их способность взаимодействовать с другими молекулами.
Формирование вторичной структуры белка обусловлено взаимодействием аминокислотных остатков между собой при помощи химических связей. Одной из ключевых связей вторичной структуры является водородная связь, которая образуется между атомами кислорода и водорода.
| Форма вторичной структуры | Описание |
|---|---|
| Альфа-геликс | Спиральное сворачивание цепи образует стержень |
| Бета-лист | «Складка» или «плиссе» белковой цепи |
Формирование вторичной структуры белка позволяет определить его третичную и кватерническую структуру, которые также играют важную роль в определении его функций и взаимодействий в клетке.
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

3. Роль химической связи
Химическая связь играет ключевую роль в формировании вторичной структуры белка. Вторичная структура белков обусловлена особенностями взаимодействия аминокислотных остатков между собой.
Одной из наиболее важных химических связей, определяющих вторичную структуру белка, является водородная связь. Водородные связи возникают между атомами водорода и атомами кислорода или азота в аминокислотном остатке. Они имеют особое значение для формирования спиральных участков альфа-геликса и сложных структур бета-складки.
Пептидная связь также играет важную роль в стабилизации вторичной структуры белка. Это особая химическая связь, которая образуется между аминогруппой одного остатка и карбоксильной группой соседнего остатка в цепи белка. Пептидная связь обладает высокой устойчивостью и угловой плоскостью, что способствует образованию спиральных участков альфа-геликса и сложных структур бета-складки.
Различные химические связи, такие как водородные связи и пептидные связи, взаимодействуют друг с другом и влияют на стабильность и форму вторичной структуры белка. Эти связи обеспечивают прочность и устойчивость белковой структуры, позволяя им выполнять свои функции в организме.
Аминокислотные остатки
Существует 20 основных аминокислотных остатков, которые могут быть использованы для построения белков. Эти аминокислоты различаются своими физическими и химическими свойствами, такими как положительный или отрицательный заряд, гидрофобность или гидрофильность и способность формировать специфические химические связи.
Аминокислотные остатки в белке связаны между собой пептидными связями, которые образуются между аминогруппой одного остатка и карбоксильной группой другого остатка. Эти связи обеспечивают линейную последовательность аминокислот в полипептидной цепи белка.
Боковые цепи аминокислотных остатков могут взаимодействовать друг с другом и с окружающей средой, образуя различные химические связи, такие как водородные связи, сольватационные взаимодействия и гидрофобные взаимодействия. Эти связи помогают определять трехмерную структуру белка и его функциональные свойства.
Важно отметить, что аминокислотные остатки несут информацию о генетическом коде и определяют последовательность аминокислот в белке, что, в свою очередь, определяет его структуру и функцию.
Водородные связи
Водородные связи представляют собой слабые химические связи, которые образуются между атомами водорода и электроотрицательными атомами, такими как кислород, азот или фтор. В природе самые распространенные водородные связи образуются между атомами водорода и атомами кислорода.
Водородные связи играют важную роль в стабилизации вторичной структуры белка. Они участвуют в формировании α-спиралей и β-складок, двух основных типов вторичной структуры. Водородная связь формируется между атомом водорода, принадлежащим карбоксильной группе одной аминокислоты, и атомом кислорода, принадлежащим аминогруппе другой аминокислоты.
Водородные связи обладают некоторыми особенностями, которые делают их особенно важными для стабильности вторичной структуры белка. Во-первых, они сравнительно слабые, но в то же время достаточно прочные, чтобы удерживать вторичную структуру в определенной конформации. Во-вторых, они динамичны и могут образовываться и разрушаться в ответ на внешние факторы, такие как температура или pH-уровень.
| Вторичная структура | Формирующие водородные связи |
|---|---|
| α-спираль | Между атомом водорода карбоксильной группы и атомом кислорода аминогруппы, расположенными на одной витой структуре. |
| β-складка | Между атомом водорода карбоксильной группы одного участка и атомом кислорода аминогруппы другого участка, при этом протяженность водородной связи может варьироваться. |
В целом, водородные связи являются важными элементами вторичной структуры белка. Они обеспечивают стабильность и устойчивость белка, что в свою очередь позволяет ему выполнять свою функцию в организме.
Пептидная связь
При образовании пептидной связи аминогруппа одной аминокислоты реагирует с карбоксильной группой другой аминокислоты, что приводит к образованию прочной и устойчивой химической связи. Эта реакция называется конденсационной реакцией, в ходе которой выделяется молекула воды.
Пептидная связь обладает уникальными свойствами, которые определяют ее важность в структуре и функции белков. Она обладает высокой прочностью и стабильностью, что позволяет белкам сохранять свою структуру и выполнять свои функции в клетках организма.
Кроме того, пептидная связь также имеет существенное значение для формирования пространственной структуры белка. Благодаря этой связи между аминокислотными остатками, белки могут принимать определенную трехмерную конформацию, которая определяет их функциональные свойства.
Таким образом, пептидная связь играет ключевую роль во вторичной структуре белка, обеспечивая его прочность и стабильность, а также участвуя в формировании его пространственной конформации. Понимание механизмов образования и свойств пептидной связи является важным шагом в изучении структуры и функции белков.
💥 Видео
Вторичная структура белкаСкачать
8 класс.Химическая связь.Скачать

Строение и функции белков.Скачать

8. Виды химической связи.Скачать

Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

Ковалентная Неполярная Связь — Химическая связь // Химия 8 классСкачать

Строение и уровни структурной организации белков. 10 класс.Скачать

Ковалентная связь. 8 класс.Скачать
Ковалентная Полярная Связь — Химическая связь // Химия 8 классСкачать

Структура белковСкачать

Первичная структура белкаСкачать

Биохимия | Строение белков часть 1Скачать

Водородная химическая связь | Химия 11 класс #6 | ИнфоурокСкачать

Определяем тип химической связиСкачать

Химическая связь. Формулы Льюиса. 8 класс.Скачать

Ерёмин В. В. - Общая химия - Строение молекул и химические связи (Лекция 3)Скачать

Аминокислоты, белки. Строение белков. Уровни организации белковой молекулы. Видеоурок по биологии 10Скачать

Как устроена первичная структура белка? Душкин объяснитСкачать

