Белки — одна из основных классов биомолекул, играющих важную роль во многих процессах в организмах. Они выполняют различные функции, в том числе структурную и каталитическую. Вторичная структура белка — это особый уровень организации, который определяется пространственным расположением аминокислотных остатков в цепи. Основными конформациями вторичной структуры белка являются α-спираль (α-геликс) и β-складка (β-лист).
α-спираль представляет собой спираль, образованную аккуратно свернутой цепью аминокислотных остатков, которая поддерживает стабильную и регулярную структуру. Важно отметить, что α-спираль образуется благодаря водородным связям между аминокислотными остатками. Эта конформация является одной из самых распространенных вторичных структур и играет ключевую роль в поддержании пространственной конформации белка.
В отличие от α-спирали, β-складка образуется в результате сворачивания белковой цепи в зигзагообразную конформацию, в которой аминокислотные остатки связаны водородными связями вдоль двух смежных параллельных или антипараллельных листов. Благодаря этому, β-складка обладает стабильной структурой и способна образовывать гибкие и жесткие участки комплексов белков.
Вторичная структура белка имеет большое значение, поскольку влияет на его функциональность и взаимодействие с другими молекулами. Она позволяет белку принимать определенную пространственную форму, которая обеспечивает его специфическую активность. Кроме того, вторичная структура является основой для формирования третичной и кватерничной структур белка.
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Альфа-спираль
Альфа-спираль представляет собой одну из основных конформаций вторичной структуры белка. При этой конформации отдельные аминокислотные остатки соединены между собой через водородные связи, образуя спиральную структуру.
Структурные особенности альфа-спирали заключаются в следующем:
- Аминокислотные остатки, составляющие альфа-спираль, образуют спиральный виток вокруг оси.
- Спиральный виток альфа-спирали имеет винтовую форму и вытянутую конформацию.
- Водородные связи, образуемые между аминокислотными остатками, удерживают альфа-спираль в стабильной форме.
Функциональная роль альфа-спирали заключается в обеспечении прочности и устойчивости белковых структур. Альфа-спираль может служить структурной основой для различных функциональных участков белка, таких как активные центры и связывающие сайты. Она также может участвовать в формировании терциарной структуры белка, определяя его пространственную конформацию.
Структурные особенности
Альфа-спираль образовывается за счет поворотов молекулы белка вокруг оси, что создает антипараллельный зигзаг-образный паттерн. Каждая витая спираль состоит из 3.6 аминокислотных остатков. Повторяющийся паттерн обеспечивает стабильность и прочность структуры, что позволяет белку выполнять свои функции.
Важной структурной особенностью альфа-спирали является ее гидрофобность. В результате взаимодействия гидрофобных остатков аминокислот, альфа-спираль формирует гидрофобный ядро, которое играет важную функциональную роль в белке.
Кроме того, альфа-спираль может образовывать поверхность, на которой располагаются положительно и отрицательно заряженные остатки аминокислот. Это позволяет белку взаимодействовать с другими молекулами и выполнять различные функции, такие как связывание и перенос других молекул в организме.
В целом, структурные особенности альфа-спирали обеспечивают ей стабильность, прочность и функциональность, необходимые для выполнения различных задач в организме.
Функциональная роль
Функциональная роль бета-складки заключается в обеспечении стабильности пространственной конформации белка и его связывания с другими молекулами. Бета-складки могут образовывать гидрофобные ямки и карманы, которые служат местом связывания липидов, ионов и других белковых молекул.
Бета-складки также могут образовывать белковые листы — плоские структурные элементы, состоящие из параллельных или антипараллельных цепочек бета-складок. Эти белковые листы могут служить основой для формирования третичной структуры белка.
Бета-складки могут быть важными для свертывания и устойчивости белковой структуры. Они обеспечивают пространственное укладывание цепочек аминокислот и формируют гибкую или жесткую структуру белка.
Важно отметить, что функциональная роль бета-складки может быть различной в разных белковых структурах. В некоторых случаях бета-складки могут выполнять структурную функцию, обеспечивая пространственную организацию белка, в то время как в других случаях они могут быть ключевыми для его функциональной активности.
Видео:Строение и уровни структурной организации белков. 10 класс.Скачать

Бета-складка
Структурные особенности
Бета-складка представляет собой вторичную структуру белка, которая образуется путем сворачивания последовательности белковых цепочек в виде параллельно или антипараллельно ориентированных локализованных участков. Основным элементом бета-складки является бета-лист, который состоит из нескольких бета-вертелов.
Бета-вертела представляет собой последовательность аминокислот, которые образуют плоское кольцо. Параллельные бета-вертела ориентированы в одном направлении, а антипараллельные — в противоположных.
Бета-листы связываются друг с другом с помощью водородных связей, образуя бета-листовой лист. В результате такого связывания образуется характерная складка, которая напоминает свернутый веер или гармошку.
Функциональная роль
Бета-складки выполняют различные функции в биологических процессах. Они могут служить для укрепления структуры белка, повышения его устойчивости к внешним воздействиям и изменению окружающих условий.
Также бета-складки могут быть вовлечены в формирование активного центра ферментов, где они способствуют установлению определенной конформации для взаимодействия с субстратом. Это позволяет ферменту катализировать химическую реакцию с высокой специфичностью и эффективностью.
Кроме того, бета-складки могут участвовать в формировании доменов белка, которые определяют его функциональные свойства и взаимодействие с другими молекулами.
Исследование структуры и функции бета-складок является важной задачей в молекулярной биологии и может привести к разработке новых лекарственных препаратов и методов лечения различных заболеваний.
Структурные особенности
Структурные особенности альфа-спирали обуславливают ее стабильность. Связи водорода образуются между атомами кислорода в амидной группе и атомами водорода в карбонильной группе. Также на стабильность альфа-спирали влияют внутренние взаимодействия аминокислотных остатков и гидрофобные взаимодействия. Эти структурные особенности позволяют альфа-спирали сохранять свою форму в различных условиях, что является важным для ее функции в белковых молекулах.
Функциональная роль
Функциональная роль вторичной структуры белка заключается в обеспечении его стабильности и устойчивости. Альфа-спираль и бета-складка способны образовывать внутреннюю структуру белка, которая позволяет ему сохранять свою форму и функциональность в различных условиях.
Альфа-спираль является наиболее устойчивой конформацией вторичной структуры белков. Она образуется благодаря водородным связям между аминокислотными остатками, которые расположены на расстоянии 3.6 ангстрем друг от друга. Альфа-спираль отличается своей спиральной формой и лежит вдоль оси белка.
Бета-складка, в свою очередь, представляет собой лист ориентированных параллельно или антипараллельно друг другу полипептидных цепочек. Они связаны водородными связями и образуют характерную «складку». Благодаря гибкости бета-складки, белки могут принимать разные конформации и выполнять свои функции, такие как связывание с другими молекулами, катализ реакций и транспорт веществ.
Именно функциональная роль вторичной структуры белка позволяет ему быть участником различных процессов в клетке и выполнять свои биологические функции. Вторичная структура белка является одним из ключевых факторов, определяющих его активность и способность взаимодействовать с другими молекулами.
💡 Видео
Биохимия. Лекция 2. Белки. Уровни организации белков. Функции белков.Скачать

Биосинтез белка за 3 минуты (даже меньше)Скачать

ДНК и РНКСкачать

Строение белка. Уровни организации белковой молекулы.Скачать
Вторичная структура белкаСкачать
Первичная структура белкаСкачать

Строение и функции белков.Скачать

Аминокислоты, белки. Строение белков. Уровни организации белковой молекулы. Видеоурок по биологии 10Скачать

Третичная структура белкаСкачать
Структуры белкаСкачать

Структурная организация белков / БИОХИМИЯ белков, биохимия аминокислот, белки теплового шокаСкачать

Структура белковСкачать

СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ. ОБЩАЯ БИОХИМИЯ. ЛЕКЦИЯ 1.Скачать

Четвертичная структура белкаСкачать

Биохимия. Конформация белков. Фолдинг белков.Скачать

Как устроена первичная структура белка? Душкин объяснитСкачать

Белки: Пространственная структура: Биорганическая химия №3.2Скачать

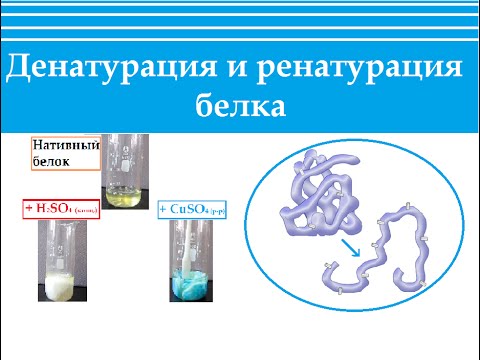
Биохимия. Денатурация и ренатурация белка. Строение белка.Скачать